图片来源于网络
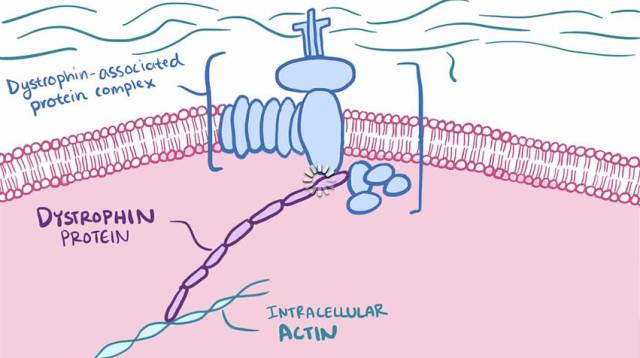
Exondys 51是第一个获批治疗杜氏肌营养不良的新药,美国食品药品管理局(FDA)于2016年9月决定准许该药上市。 之所以有51的是因为它能够诱导肌营养不良蛋白mRNA中外显子51跳跃。 鲜为人知的是,围绕这个新药,两家公司打了一场旷日持久的的专利的官司。 两年前,当时的美国专利商标局(USPTO)的专利审判和上诉委员会做出判决,取消了Exondys 51的方法专利,几乎断绝了其继续研发的前景。 这是因为,当时Exondys 51(eteplirsen)的研发者Sarepta和另一家公司BioMarin明争暗斗。BioMarin自己也有一款同一个种类的新药,drisapersen,同样针对肌营养不良蛋白的第51个外显子跳跃。 一山难容二虎,到底谁将胜出? 当时,专利委员会做出了对BioMarin有利的判决,所有目光都集中在后者身上。 但是,FDA并没有对此表示同意,这个新药审评机构同年拒绝了BioMarin的drisapersen的申请,理由是已有证据不足和毒性。 当然,FDA最初也拒绝了Sarepta的申请。但是最终还是迫于压力,于2016年9月批准了Sarepta的eteplirsen。 围绕这场官司,BioMarin和Sarepta最近达成和解。BioMarin将eteplirsen的全球专属的专利权授予了Sarepta,从而获得了3500万美元的一次性现金付款。此外,如果eteplirsen的全球销售达到6.5亿美元,BioMarin好的获得1500万美元的进账。 欧洲的欧盟医药局EMA正在审理这个新药,如果获批,那么BioMarin还将获得1000万美元付款。 虽然只治疗13%的DMD肌营养不良的患者,但是自从上市以后,Sarepta的etelirsen在第一季度就销售了1630万美元,成功超过了1300万到1500万的预期的上限,可谓一炮打响,可喜可贺。 公司预计,全年的销售额将达到9500万美元。 根据与BioMarin签订的协议,Sarepta承诺,其开发的每一个靶向肌营养不良蛋白dystrophin基因外显子的药物(外显子51除外),BioMarin都有资格获得高达2000万美元监管里程碑款项。 Sarepta目前正在针对外显子45和53的候选药物casimersen(SRP-4045)和golodirsen(SRP-4053)进行三期临床试验。 BioMarin有权在这些新的外显子跳跃药物中获取特许权使用费。 当然,有医保覆盖是此药能取得如此骄人成绩的保障,但是,这个专利之争也从侧面说明,罕见病的创新也能带来钵满盆满,给专利使用者丰厚回报。 参考文章: https://www.biocentury.com/bc-extra/company-news/2017-07-18/sarepta-biomarin-settle-exondys-51-patent-dispute 本文由 健点子ihealth 授权转载