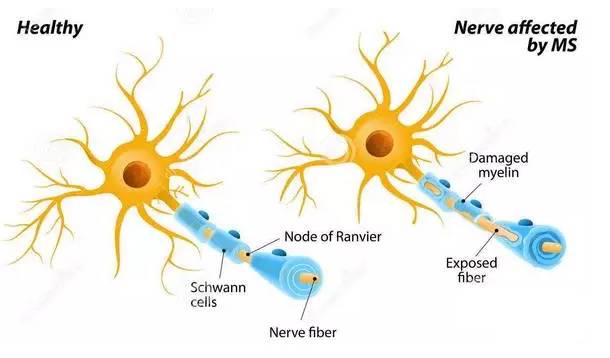
Mechanism of multiple sclerosis
多发性硬化症简介
多发性硬化症(multiple sclerosis,MS)是一种中枢神经系统脱髓鞘疾病,青、中年多见,临床特点是病灶播散广泛,病程中常有缓解复发的神经系统损害症状,其具体发病机制尚未清晰。患者以20~40岁女性为多,临床病程数年至十余年不等,以反复发作与缓解交替为其特点,缓解期长短不一。神经系统的症状因累及部位不同而颇为多样。
多发性硬化症是一种中枢神经系统的疾病,也就是说它的病变位于脑部或脊髓。我们的神经细胞有许多树枝状的神经纤维,这些纤维就像错综复杂的电线一般,在我们的中枢神经系统中组织成绵密复杂的网络。大自然很巧妙的在我们神经纤维的外面包裹着一层叫“髓鞘”的物质,髓鞘不仅像电线的塑料皮一样让不同的电线不致短路,同时人体的髓鞘还可以加速我们神经讯号的传导。当这些髓鞘被破坏后,我们神经讯号的传导就会变慢甚至停止。多发性硬化症就是因为在中枢神经系统中产生大小不一的块状髓鞘脱失而产生症状。
多发性硬化症具有高度的异质性,通常将其分为三类亚型,分别为复发型(RFMS,relapsing forms of MS)、原发进展型(PPMS,primary progressive MS)及进展复发型(PRMS,progressive relapsing MS)。其中RFMS又可进一步细分为复发缓解型(RRMS,relapsing remitting MS)及继发进展型(SPMS,secondary progressive MS)。大约80%的RRMS患者最终会发展成为SPMS。
多发性硬化症现有药物市场
全球范围内,多发性硬化症影响着大约230万人的生活,其中大部分患者为RFMS,占比高达约85%;而PRMS及PPMS两种亚型分别占比为5%及10%。尽管全球发病率很低,但多发性硬化症一直是生物制药市场中最具活力的领域之一,自2010以来已有超过五个新药获批。2011年至2016年间,MS治疗领域市场年均复合增长率为12%。
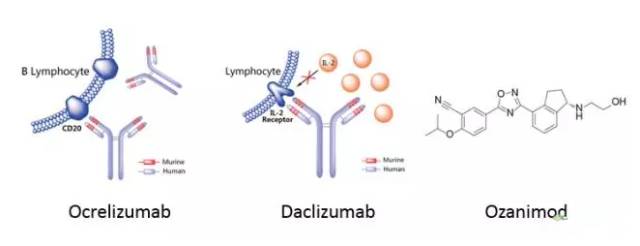
截止2016年底,所有获批的针对多发性硬化症的药物适应症均为RFMS,尚未有针对PPMS的相应药物。2017年3月份,由Genentech开发的Ocrelizumab(商品名为Ocrevus)获得美国FDA批准上市,成为第一种可用于治疗RFMS及PPMS的药物,如上图所示。该药物是一种人源化IgG1型单克隆抗体,能结合B细胞及其前体细胞表面的CD20,诱发抗体以来的细胞毒作用和补体介导的细胞毒作用。该药物销售峰值有望在2022年达到40亿美金,如下图所示。
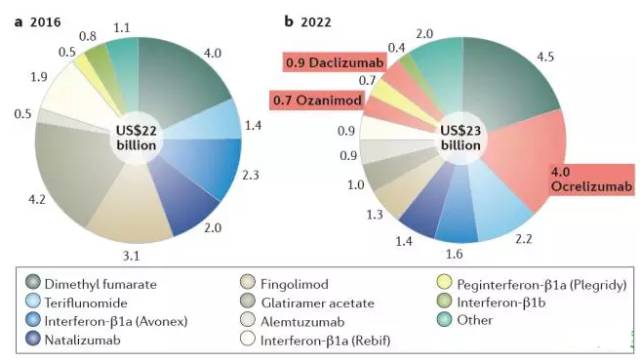
The global market for multiple sclerosis drugs
尽管增长迅速,但Ocrelizumab进入的是一个非常成熟的药物治疗领域。全球范围内,MS治疗药物市场预计2016-2022年间,市场容量仅仅从220亿美元增长至230亿美元。预计伴随着小分子药物Fingolimod仿制药及单抗药物Natalizumab生物仿制药的出现,现有治疗药物及后续新开发药物将不得不面临严峻的价格压力。现有治疗方案绝对数量之多,让很多医生不需要尝试新型药物即有大量选择可供使用。
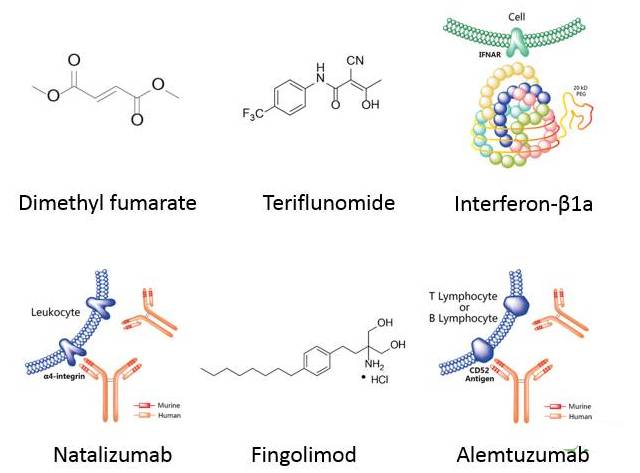
为了分析即将出现的新型药物如何影响MS治疗领域及相关药物市场,我们选取了85种处于临床阶段的多发性硬化症治疗药物,其中有12种正处于临床Ⅱ/Ⅲ期阶段。从药物管线我们可以看出,针对MS领域的药物创新主要有三类思路,分别是新型免疫调节剂、靶向S1PR受体类药物及神经修复剂,如下表所示。
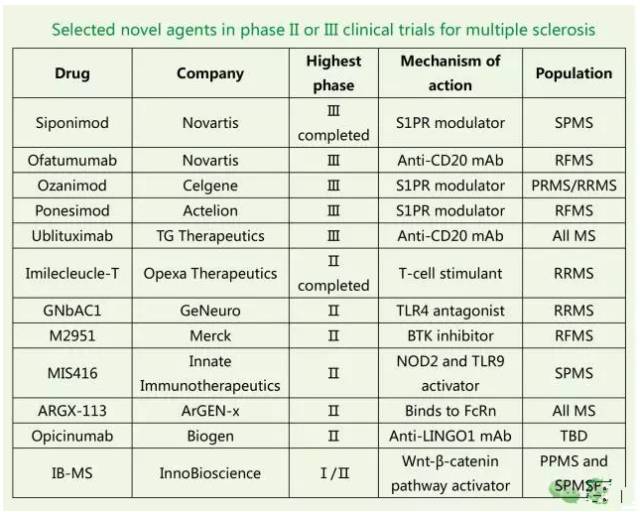
新型免疫调节剂类药物
新型免疫调节剂可以抑制多发性硬化症中的自身免疫性成分,从而延缓对于髓鞘的损伤;该类药物相比于早期药物具有更佳的疗效及更好的安全性。更为重要的是,Ocrelizumab对RFMS及PPMS均表现出良好的疗效。在代号为OPERA1及OPERA2的两项三期临床研究中,相比于IFNβ1a,Ocrelizumab针对年度复发率的改善程度可达47%。而针对PPMS的三期临床研究中,相比于安慰剂组,Ocrelizumab可将致残性疾病进展风险降低16%。由于该项研究的对象限定于活动性病变的患者,因而也引发了对于该药物是否适用于所有PPMS患者的关注。Ocrelizumab的安全性与IFNβ1a的600mg获批剂量相当。
S1PR调节剂类药物
S1PR蛋白家族成员参与了众多重要的细胞生理过程,包括细胞增殖、新生血管生成及免疫细胞输送等。Fingolimod是第一款S1PR蛋白调节剂,也是第一款针对多发性硬化症的口服性调节药物,于2010年获得FDA批准在美国上市,2016年全球销售额超过30亿美元。Fingolimod的使用由于诱发心脏病的风险而受到一些限制,包括心动过缓、QT间期延长的风险等。这些并发症的产生据推测是由于药物对S1PR3的激活所造成,后者与心脏节律调节相关;而S1PR1及S1PR5则被认为是该药物在多发性硬化症治疗中发挥作用的靶点所在。
另外一些有望获批的S1PR调节剂目前正处于三期临床研究阶段,包括Celgene的Ozanimod、Actelion的Ponesimod及Novartis的Siponimod等。其中,Ozanimod及Ponesimod很可能在2018年获批进入市场,而Novartis则正寻求尽早提交Siponimod的申请,因此上述三类药物有望在未来两年内全部获批进入多发性硬化症治疗领域。
Celgene近期完成了Ozanimod的三期临床试验,且结果较为积极。在2016年完成的针的一项二期临床研究中,Ozanimod相比于安慰剂组表现出色。或许更为重要的是,相比于Fingolimod,该药物具有更好的安全性,特别是在心脏安全方面。
Ponesimod同样也是S1PR调节剂,尽管相比于新的竞争性抑制剂,其对S1PR1的选择性要低一些。据报道,Ponesimod对S1PR1的选择性要比S1PR3高约650倍。相比之下,Ozanimod的对S1PR1的选择性要比S1PR3高约10000倍,因而也是一项更为安全的候选药物。在一项二期临床研究中,Ponesimod可降低累计病灶数从安慰剂组的6.2至药物组的1.1,采用剂量为后续三期临床研究所使用的20mg。
Siponimod是由Novartis研发的二代S1PR调节剂,该药物为Fingolimod的衍生物,对S1PR1的选择性要比S1PR3高10000倍。目前诺华致力于拓展该药物在SPMS适应症上的应用,一个潜在的原因是避免同Fingolimod在RFMS治疗领域的直接竞争。在代号为EXPAND的三期临床研究中,Siponimod在晚期SPMS患者中表现较为出色。
神经修复剂类药物
神经修复是一类靶向于炎症反应之外的新颖的MS治疗思路,并具有改善残疾病症的潜力。进展最为迅速的神经修复剂类药物是Biogen的单抗药物Opicinumab,后者靶向于LINGO1并且能够促进髓鞘再生。在针对RFMS患者的临床Ⅱb期实验中,Opicinumab疗效不佳,在改善残疾、神经症状及认知等方面未能达到预设终点。尽管如此,在对患者群体进一步细分时,研究人员发现该药物对于40岁以下,患有轻度RRMS且病期小于8年的患者疗效更为显著。这些患者将有望成为Biogen开展下一期Ⅱ期临床研究的目标群体。
AbbVie公司开发的Elezanumab(研发代码ABT-555)是靶向于RGMA的单克隆抗体类药物,可以刺激轴突再生、髓鞘再生并具有神经保护作用。在动物模型中证实了其刺激髓鞘再生功效后,目前该药物已推进至临床一期研究中。
对于神经修复剂类药物而言,所面临的一大挑战是如何有效评估其真实疗效,特别是在临床试验中的效果。该类药物或许不会影响RRMS所伴随的炎症反应,因而也不会改变年度复发率等常用的临床试验预设终点。Opicinumab的二期临床研究采用了一种新颖的多组分复合终点方式进行判定,包括对残疾状况、神经行为和认知症状等方面的改善。尽管历史沿袭上FDA并不支持采用此类复合终点方式进行判定,但这或许是能够反映神经修复剂类药物疗效的最佳方式。
除了上述三大类药物开发思路外,还有其他一些新型候选药物也处于不同的临床研发阶段如Merck的M2951、GeNeuro公司的GNbAC1及InnoBioscience的IB-MS等,分别靶向于BTK激酶、TLR4及Wnt-β-catenin信号通路等。
小结
在过去的数年里,伴随着Fingolimod、Dimethyl fumarate、Alemtuzumab及Ocrelizumab等药物的研发及获批使用,人类在延缓多发性硬化症进展领域取得了长足的进步。Ocrelizumab在RPMS患者群体中疗效甚佳,并改变了PPMS患者群体的治疗模式。进一步讲,新型具有修复潜力的药物的开发,如Opicinumab及Elezanumab等,或许能够逆转该致残性疾病给患者所带来的损伤,这将是一个具有变革性的治疗概念。
缩略词表:
BTK:Bruton tyrosine kinase
LINGO1:leucine-rich repeat and immunoglobulin-like domain-containing nogo receptor-interacting protein 1
mAb:monoclonal antibody
MS:multiple sclerosis
NOD:nucleotide-binding oligomerization domain-containing protein
PPMS:primary progressive MS
PRMS:progressive relapsing MS
RFMS:relapsing forms of MS
RRMS:relapsing remitting MS
S1PR:sphingosine 1-phosphate receptor
SPMS:secondary progressive MS
TLR:Toll-like receptor
参考文献:
1.The multiple sclerosis market. Nature Reviews Drug Discovery (2017) doi:10.1038/nrd.2017.107
2.http://www.msif.org/wp-content/uploads/2014/09/Atlas-of-MS.pdf
3.Exploring the origins of grey matter damage in multiple sclerosis. Nature Reviews Neuroscience 16,147–158 (2015) doi:10.1038/nrn3900
4.From genes to function:the next challenge to understanding multiple sclerosis. Nat Rev Immunol.2009 Jun;9 (6):408-17.doi:10.1038/nri2554.
5.Immunopathology of multiple sclerosis. Nat Rev Immunol.2015 Sep 15;15 (9):545-58.doi:10.1038/nri3871.
6.Multiple sclerosis:a complicated picture of autoimmunity. Nat Immunol.2007 Sep;8 (9):913-9.
7.https://en.wikipedia.org/wiki/Multiple_sclerosis
8.抗体药物示意图来源于药渡官网。
本文由 药渡 授权转载