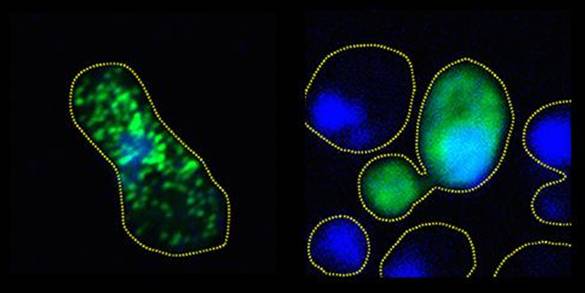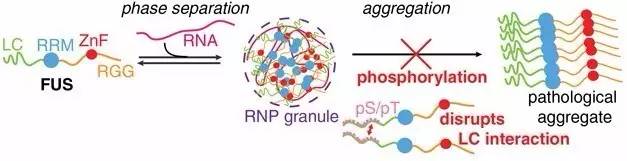
通过将FUS蛋白质人为暴露于磷酸化自然过程,研究人员能够防止它们形成与ALS和FTD相关的有害团块。 科学家们报告,在一项模仿一种细胞自然过程的新研究中,他们防止了与肌萎缩侧索硬化(ALS)和额颞叶痴呆(FTD)相关联的蛋白质团块形成。 在人类和酵母细胞的实验室培养中,科学家们通过将它们暴露于磷酸化作用(phosphorylation),阻止了有害的FUS蛋白质聚集。磷酸化作用是一种精确改变蛋白质构筑模块氨基酸的过程,能够增加它们的负电荷。研究表明,电荷增加会导致蛋白质在通常可能聚合的情况下相互排斥。 这些发现可能最终对ALS(通常被称为卢伽雷氏症)和痴呆的治疗产生积极影响。 “之前没有人表明你可以使用电荷,也没有表明磷酸化作用是一种获得电荷从而破坏这些ALS相关蛋白质聚合物的方法,”布朗大学分子药理学、生理学和生物技术学系助理教授Nicolas Fawzi说道。 磷酸化作用会由于各种原因而在全身细胞中发生。作为一系列DNA损伤相关事件的一部分,细胞在FUS蛋白质上进行磷酸化作用。在这项新研究中,研究人员通过替换FUS蛋白质中的特定氨基酸来检查自然磷酸化和人工磷酸化作用。 这项研究由来自布朗大学、统一服务大学(UniformedServices University)、约翰霍普金斯大学、理海大学和美国国立卫生研究院的研究者团队进行,研究成果发表于EMBO Journal。 研究步骤 这项计划开始于布朗大学Fawzi的实验室,他一直在这里研究FUS以及与神经退行性疾病密切相关的类似蛋白质的结构和生物物理学。他和共同领导作者、布朗神经科学研究生Veronica Ryan想要探索磷酸化作用如何以及是否会影响FUS蛋白质聚集在一起的方式。FUS聚集会破坏神经元的健康。 第一项任务是识别FUS区域中用于和其他蛋白质结合的几个特定氨基酸位点。在这些位点,天然酶DNA-依赖蛋白质激酶(DNA-PK)会引起磷酸化作用。 他们与统一服务大学的合作者们(包括共同领导作者Zachary Monahan和共同通讯作者Frank Shewmaker)通过确认人类细胞源性FUS中的这些和更多的磷酸化位点来继续研究。 研究团队识别出超过12个位点,然后开始在活体细胞培养中模仿DNA-PK。Monahan和Shewmaker的团队改造人类FUS进入啤酒酵母,并在人类细胞培养中实现了磷酸化模仿。 他们在两种培养中都观察到的是,通过提高磷酸化作用的程度——从2个位点直至12个位点——他们可以成比例地减少蛋白质聚合成团块的倾向。 在酵母细胞中,他们表明,越有效地防止完全聚合——通过增加更多的模拟磷酸化作用的位点——细胞生长得越健壮。这一发现证明FUS聚集对细胞具有毒性。 破坏性的FUS。绿色荧光FUS在左侧未经处理的酵母细胞中形成紧密团块,而在右侧磷酸化的细胞中,该蛋白质依然分散而未聚集。 Ryan、Abigail Janke 和布朗大学的同事们显示了磷酸化作用如何破坏FUS分子之间的联系。与此同时,在共同作者、理海大学Jeetain Mittal的共同领导下,蛋白质结构中磷酸化作用的计算建模表明,电荷的改变是导致蛋白质聚合可能性差异的原因。 疗法地平线 Fawzi承认,这种科学家们在实验室中使用的方法还不构成神经退行性疾病的实用疗法,但他表示,证明磷酸化作用可以用于破坏蛋白质聚合,应该会激励进一步研究来产生治疗方法。 “ALS和FTD目前无法治愈,”Fawzi说,“我们需要的是新的假设和新的角度。” Fawzi假设,由于磷酸化作用是一种细胞的自然过程,关键可能是找到一个可以在需要时打开的“开关”。他还指出,许多制药公司拥有非常活跃的研究小组,致力于利用DNA-PK这样被称为激酶的磷酸化酶。 他说,未来疗法可能必须靶向——定位于FTD病例的大脑,或者集中于ALS病例的运动神经元。考虑到FUS在帮助细胞处理RNA和修复DNA方面可能的重要作用,在身体中更普遍地对其进行磷酸化可能是有害的。 目前,这项合作研究主要集中在一种神经退行性疾病模型中特异性测试磷酸化作用,而不是在一般细胞中进行,Fawzi说道。 原文链接: https://news.brown.edu/articles/2017/08/neurodegeneration ------------------ 原文翻译/曹文东 校审/夏蓓 本文由中国罕见病网编译,转载请注明出处。