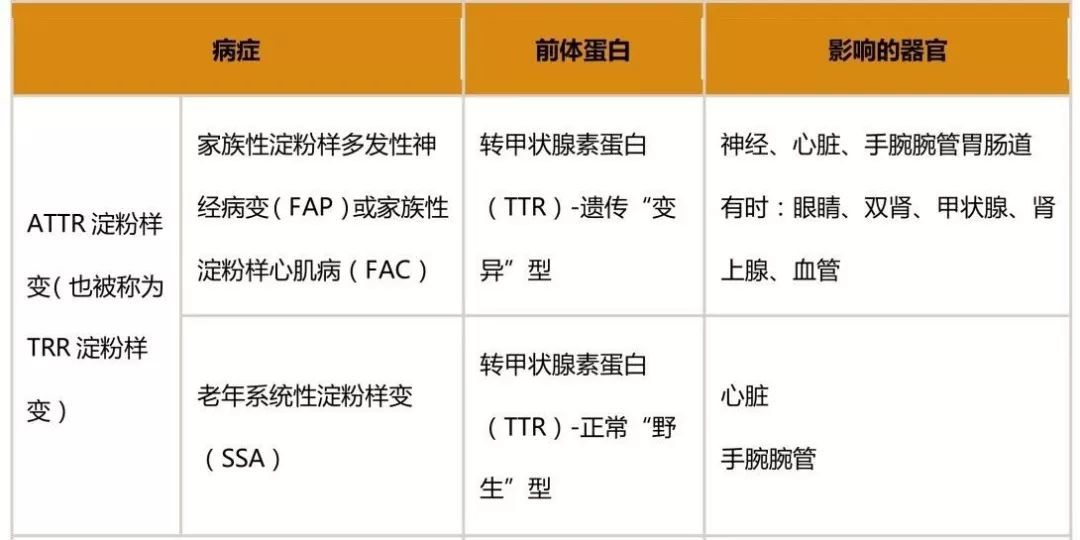
Eidos疗法公司(Eidos Therapeutics, Inc.)是一家临床阶段生物制药公司,专注于解决转甲状腺素蛋白(TRR)淀粉样变性(ATRR)巨大和不断增长的未满足需求,该公司近日宣布:美国食品与药物管理局(FDA)授予其候选产品AG10治疗ATTR的孤儿药资格认定。
TTR通常作为四聚体(一种四部分构成的分子)在血液中循环,但在ATTR中,四聚体会失去稳定性并分解为单个单体,聚合成淀粉样原纤维。Eidos公司的领先候选产品AG10被设计为通过稳定血液中四聚体的TTR而靶向ATTR的源头。Eidos公司正在研究AG10用于治疗进行性致命的ATTR心肌病(ATTR-CM)和ATTR多发性神经病(ATTR-PN)。公司计划2019年上半年发起治疗这些适应证的3期研究。
点击可放大图片查看
“获得治疗ATTR的孤儿药资格认定,是领先候选产品AG10和我们公司向前迈出的重要一步,”Eidos公司总裁兼首席医疗官Jonathan Fox博士说,“我们相信,AG10在成为ATTR患者疾病修饰疗法方面颇具潜力,而孤儿药地位将帮助我们尽可能快地开发它。”
孤儿药资格认定授予的是那些用于治疗罕见病(美国患者数量少于20万的疾病)的药物,为这些药物的开发提供激励和支持,包括批准上市后7年的市场独占权,豁免FDA申请用户费用,和对合格临床试验费用的税收抵免。
关于AG10
AG10是一种研究性、口服给药的小分子,设计为强力稳定四聚体TTR,从源头阻断导致ATTR的一系列分子事件。AG10目前正在进行一项治疗ATTR心肌病患者的2期临床试验,预计将在2018年底前报告顶线结果。
外文:FDA GRANTS ORPHAN DRUG DESIGNATION TO EIDOS THERAPEUTICS’ PRODUCT CANDIDATE, AG10, FOR TREATMENT OF TRANSTHYRETIN AMYLOIDOSIS