1. 轴突变性
Disarm公司发布验证SARM1在轴突变性中作用的新数据
图片来源 Disarm Therapeutics 官网
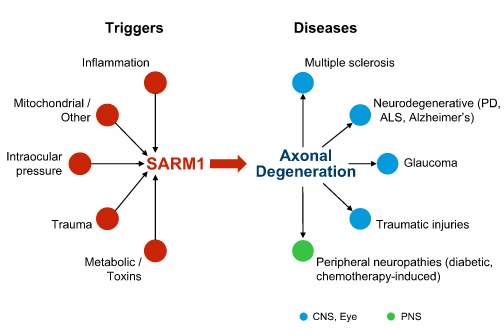
Disarm Therapeutics公司在2018年神经科学大会上介绍的数据表明,SARM1基因的遗传缺失能够保护中枢和周围神经系统中的轴突,同时相应减少一种经临床验证的轴突变性生物标志物——血液神经丝轻链(NF-L)。
Disarm公司还发现,SARM1抑制能够降低两种生物标志物——血液NF-L和cADPR——为SARM1小分子抑制剂的开发提供了关键见解。
Disarm公司的科学创始人识别出SARM1是轴突变性的核心驱动因素。轴突变性是一种存在于广泛神经疾病的常见但尚未解决的病理,会导致中枢、眼睛和周围神经系统慢性和急性疾病比如多发性硬化症、肌萎缩侧索硬化症、青光眼和周围神经病的残疾和病情进展。Disarm公司正在开发疾病修饰性SARM1抑制剂以治疗轴突变性。
2. 库欣综合征(CS)
FDA批准高分辨率MRI以更好地检测库欣病患者的垂体瘤
美国食品与药物管理局(FDA)近日批准磁共振成像扫描仪——超高场7T Terra MRI——的临床应用。该扫描仪前所未有的高分辨率可以提供更可靠的脑部图像。
新扫描仪的磁场强度增加了7特斯拉,是传统MRI的4倍以上。到目前为止,这种扫描仪在美国只有一台,2017年2月安装在南加州大学凯克医学院Mark and Mary Stevens神经成像与信息研究所(INI)。
3、AGHD
Strongbridge公司收购MACRILEN™(macimorelin)在美国和加拿大的权利

Strongbridge Biopharma公司近日宣布与诺和诺德公司达成协议,收购MACRILEN™(macimorelin)在美国和加拿大的权利。MACRILEN是首个也是唯一获得FDA批准用于成人生长激素缺乏症(AGHD)诊断的的口服溶液。
AGHD是一种与病态和死亡增加相关联的罕见病。美国有超过50000人被诊断为生长激素(GH)缺乏症患者。AGHD患者包括儿童期GH缺乏后来成为AGHD成人的人,也包括成年后出现GH缺乏的人。未经诊断的AGHD可能会导致早亡风险增加,出现严重病态,包括体脂增加、骨折率增加、肌肉质量减少、血脂异常、无力和疲劳、心血管疾病、骨质疏松和心理健康受损,比如孤立、焦虑和抑郁。
4. 淀粉样变性
研究人员开发出新的分期系统以预测淀粉样变性患者生存状况
波士顿医学中心淀粉样变性中心和波士顿大学医学院的研究人员开发出一种新的分期系统,通过更易于使用的试验来预测轻链(AL)淀粉样变性患者的生存机会,结合了心脏生物标志物以准确识别该病中心脏受到的影响,使得医生能够预测AL淀粉样变性患者的预后。
AL淀粉样变性是一种罕见病,患者骨髓产生无法分解的异常抗体,沉积在组织中干扰器官功能。AL淀粉样变性患者的生存期与心脏受累有关,因此心脏生物标志物可以作为风险分层分期的准确指标。
研究人员分析了250名2016年4月到9月在淀粉样变中心接受两种测试的参与者的数据。这项研究发表于美国血液学会期刊《血液》(Blood),发现BU生物标志物系统在准确识别心脏受累和患者生存期分类方面与现有系统水平相当。
5、溶酶体贮积症
Abeona和REGENXBIO公司达成治疗罕见溶酶体贮积症的全球独家许可
图片:beona Therapeutics Inc 官网
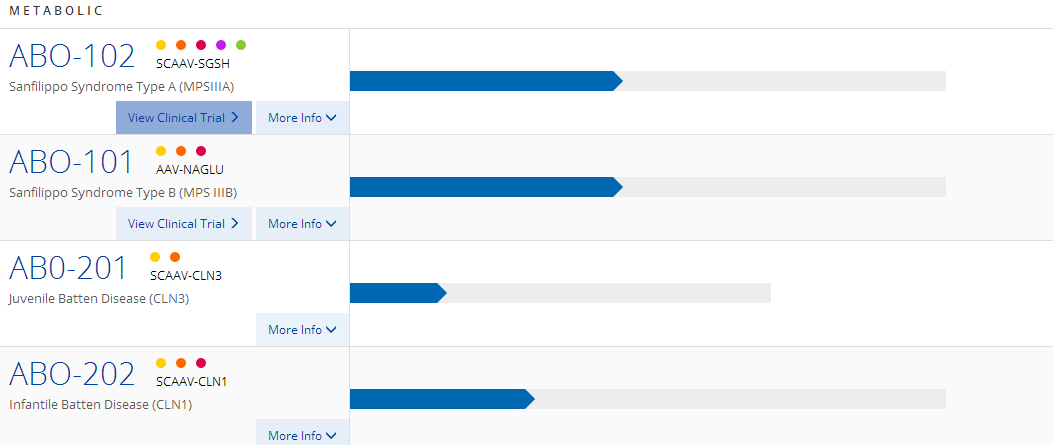
Abeona Therapeutics公司近日宣布与REGENXBIO公司达成许可协议,使用其NAV AAV9载体治疗4种疾病:Sanfilippo综合征A型(MPS IIIA)、Sanfilippo综合征B型(MPS IIIB)、婴幼儿巴腾病即神经元蜡样脂褐质沉积症1型(CLN1病)和青少年巴腾病即神经元蜡样脂褐质沉积症3型(CLN3病)。
Sanfilippo综合征或MPS III,是一组罕见遗传性溶酶体贮积症,目前尚无获批的治疗方法。MPS III的特征是攻击性行为、癫痫发作、言语或视力丧失、失眠和早亡。据估计,70%的MPS III患儿会在18岁之前离世。该综合征的基础病因是缺失一种分解硫酸肝素所必需的酶。
婴幼儿和青少年巴腾病即CLN1和CLN3,都是罕见的常染色体隐性遗传病,目前尚无获批的治疗方法。巴腾病是致命的,大多数患者会在二三十岁时离世。该病的基础病因是溶酶体功能的关键蛋白缺乏,造成脂质异常堆积,导致神经炎症和神经变性退化。CLN1和CLN3可以通过各自的基因突变进行区分。
6、罕见胆汁淤积性肝病
Mirum公司斥资1.2亿美元支持罕见淤积性肝病药物开发
Mike Grey, chairman and CEO of Mirum Pharmaceuticals. (Mirum Pharmaceuticals)
Mirum Pharmaceuticals公司近日宣布在A轮融资中获得1.2亿美元,以支持其罕见胆汁淤积性肝病领先候选药物maralixibat的开发。Maralixibat是一种顶膜钠依赖性胆汁酸转运体(ASBT)口服抑制剂。
Mirum公司还宣布,已经与夏尔达成一项全球独家开发和销售maralixibat的协议。Maralixibat正在被用于治疗Alagille综合征(ALGS)和进行性家族性肝内胆汁淤积症(PFIC)。
ALGS是一种影响肝脏、心脏、骨骼、眼睛和肾脏的罕见遗传病。常见症状通常出现在生命的最初3个月内,包括胆汁淤积、黄疸、体重增加和生长缓慢、严重瘙痒和面色苍白、稀便。
PFIC会导致进行性肝病。患者会出现严重瘙痒、黄疸、体重无法增加、生长速度无法达到预期、门静脉高压和肝脾肿大等症状。
7、急性肝卟啉症(AHP)
Alnylam公司公布Givosiran治疗急性肝卟啉症的最新结果
图片来源:Alnylam Pharmaceuticals 官网
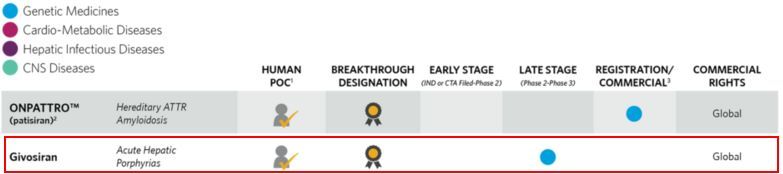
Alnylam Pharmaceuticals公司近日公布了正在进行的givosiran治疗急性肝卟啉症(AHP)1/2期非盲扩展研究的最新结果。Givosiran是一种靶向氨基乙酰丙酸合酶1(ALAS1)的研究性RNAi疗法。相关数据在美国肝病研究协会(AASLD)2018年肝脏会议上进行了介绍。
AHPs是一种潜在危及生命的罕见家族性遗传病,包括4种亚型:急性间歇性卟啉症(AIP)、遗传性粪卟啉症(HCP)、混合型卟啉症(VP)和ALAD-缺乏性卟啉症(ADP),4种亚型均由基因缺陷导致肝内血红素生物合成通路缺乏酶而引发。目前还没有预防该病发作和治疗其慢性症状的获批疗法。
Givosiran是一种靶向ALAS1的皮下给药RNAi疗法,正在开发用于治疗AHP。Givosiran获得了美国和欧盟治疗AHP的孤儿药资格认定。Givosiran的安全性和有效性目前正在3期ENVISION临床试验和1/2期OLE研究中进行评估。
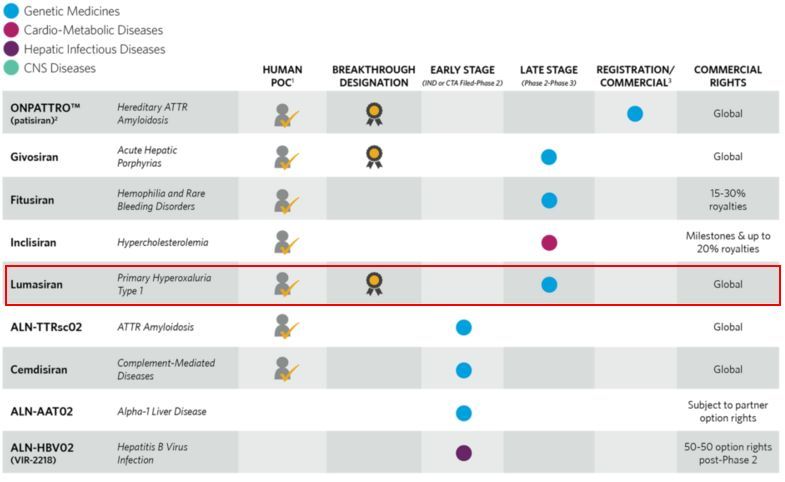
8、原发性高草尿酸症(PH)
Alnylam公司改进1型原发性高草尿酸症诊断并就3期试验设计与FDA达成一致
图片来源:Alnylam Pharmaceuticals 官网
Alnylam Pharmaceuticals制药公司近日宣布扩大Alnylam Act®项目,以包括对可能携带丙氨酸乙醛酸氨基转移酶(AGXT)基因突变的成人和儿童的免费、第三方基因检测和咨询。AGXT基因已知是与1型原发性高草尿酸症(PH1)有关的关键基因,而PH1是一种以肝脏病理性草酸产生过多为特征的超罕见、常染色体隐性遗传病。
该公司还宣布就ILLUMINATE-B的试验设计与FDA达成一致。ILLUMINATE-B即皮下RNAi疗法lumasiran治疗PH1的3期非盲研究,将招募8名6岁以下肾功能较好的PH1患者,主要终点是尿草酸从基线到6个月的减少百分比,长期随访5年。
Lumasiran(之前被称为ALN-GO1)是一种靶向乙醇酸氧化酶(GO)的研究性RNAi疗法,正在开发用于治疗PH1。Lumasiran已经获得美国和欧盟的孤儿药物资格认定,还获得了FDA的突破性疗法资格认定,以及欧洲药物管理局(EMA)的优先药物(PRIME)资格认定。
PH1是一种超罕见病,草酸产生过多造成草酸钙结晶沉积在肾脏和泌尿道,并导致肾结石和肾钙质沉着症的形成和复发。目前的治疗选择非常有限,包括频繁的肾透析或肝肾联合器官移植。虽然少数患者对维生素B6治疗有应答,但目前尚无获批的药物疗法。
9、多发性硬化症(MS)
训练免疫细胞可以改善多发性硬化症状
导致腺热的常见EB病毒(EBV)几乎存在于所有MS患者中,长期以来一直被认为是该病病因。昆士兰医学研究所的研究人员们在一项小型试验中发现,通过训练身体免疫细胞对抗EBV,70%多发性硬化症(MS)患者的症状获得改善。
EBV是疱疹病毒家族成员,在大部分携带者体内处于休眠状态,活跃时则会引起腺热。但在一些人中,被这种病毒感染的细胞会进入大脑或脊柱,并分解神经周围被称为髓磷脂的脂肪性保护层,造成神经损伤,导致MS令人衰弱的症状。研究人员从MS患者体内取出免疫细胞,训练它们对抗EBV,然后注射回患者血液。
治疗后,10名患者中的7名表示MS症状有所改善,精力更充沛,注意力更集中,视力和平衡也有所改善。
10、淀粉样变性
2018年FDA批准两种hATTR淀粉样变性疗法
2018年7月,同一期《新英格兰医学杂志》(New England Journal of Medicine)报道了两项不同的3期临床试验,这两项试验分别证明了两种不同药物治疗ATTR淀粉样变性多发性神经病的有效性。在随机、双盲、安慰剂对照试验中,两种药物都显示出减缓或改善遗传性ATTR(hATTR)淀粉样变性相关周围神经病变的疗效。
这些试验被接受作为对药物有效性的充分证明,美国FDA因此批准patisaran/OnpattroTM(Alnylam Pharmaceuticals公司)和inotersen/TegsediTM(Ionis/Akcea Therapeutics公司)作为ATTR淀粉样变性的首批治疗药物,用于治疗存在神经病变证据的hATTR淀粉样变性患者。
此外,今年8月,《新英格兰医学杂志》报道了第三项3期临床试验,描述了另一种药物(tafamidis或VyndaqelTM,辉瑞公司)的疗效,但试验对象是ATTR心肌病患者。与上述试验不同的是,该试验(ATTR-ACT)显示tafamidis治疗充血性心力衰竭患者生存期方面优于安慰剂,意味着随机接受该药物治疗的患者比未接受该药物治疗的患者生存期更长。FDA尚未决定是否批准该药物。
这三种新药通过不同的机制发挥作用,以达到相同的临床目的——阻止或逆转与ATTR淀粉样变相关的神经病变或心力衰竭的进展。
11、视网膜母细胞瘤
研究人员阻止细胞和动物中致命眼部癌症的扩散
通过比较癌症扩散与未扩散儿童眼部肿瘤的基因序列,约翰·霍普金斯大学医学研究人员报告了新的证据,表明细胞中的“多米诺效应”是导致癌症扩散的原因。他们在斑马鱼和人类细胞中成功完成的实验表明,阻断部分事件链可以阻止眼肿瘤细胞的生长和扩散。
研究人员说,这些新发现为治疗儿童最常见眼部癌症——视网膜母细胞瘤(retinoblastoma)——提供了有吸引力的靶点。据世界卫生组织估计,这种癌症影响全球约7000到8000名儿童,每年会造成4000人死亡。
为了揭示与肿瘤扩散有关的一系列分子作用,约翰·霍普金斯大学研究人员首先分析了来自10名患者的组织,其中5名患有侵袭性肿瘤,5名患有非侵袭性肿瘤。研究人员比较了两组患者的RNA图谱,发现与非侵袭性视网膜母细胞瘤细胞相比,侵袭性细胞中编码激活素a受体1C型(ACVR1C)的基因的RNA水平增加2到3倍。这一发现之所以引人注目,是因为激活素受体基因已知在其他癌症中发挥作用,包括胆囊癌和乳腺癌。研究人员认为激活素受体可能是抑制视网膜母细胞瘤细胞扩散和生长的关键靶点。
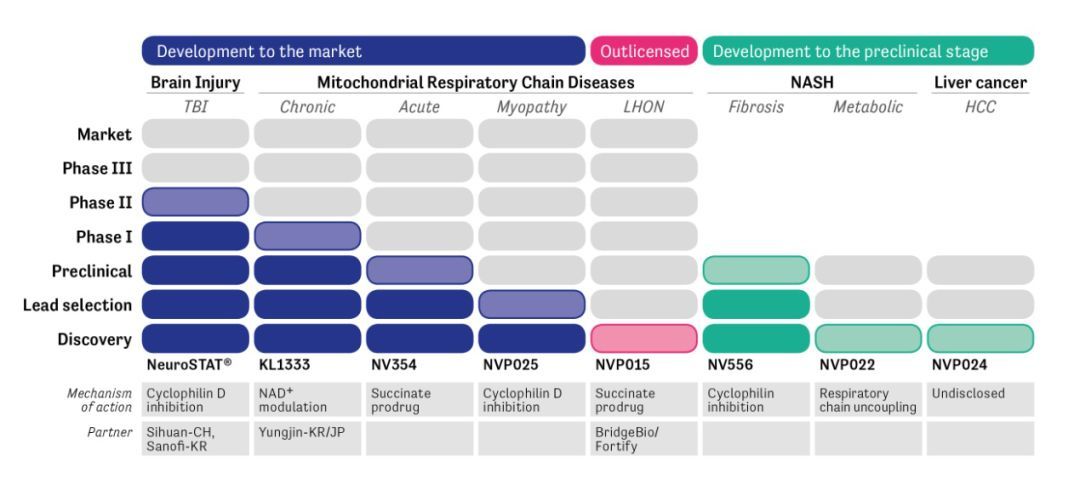
12、线粒体疾病
NeuroVive公司开发NV354作为遗传线粒体疾病新疗法
图片来源:NeuroVive Pharmaceutical AB 官网
NeuroVive Pharmaceutical AB公司近日宣布:获得瑞典创新局Vinnova和Swelife call项目首笔150万克朗(共计将为500万克朗)资助,用于加强NVP015计划的开发,目标是推动候选化合物NV354进入临床研究。
今年早些时候,NeuroVive公司报告了NV354的最初临床前有效性结果,此外在几种不同的线粒体疾病实验模型中也看到了更令人信服的有效性数据。除了自身研究外,NeuroVive公司线粒体医学研究方面的著名学术合作伙伴,比如费城儿童医院,也在进行独立研究,以便在NV354临床开发之前获得更多有价值的数据。
遗传线粒体疾病是影响细胞能量转换能力的代谢性疾病。根据受遗传缺陷影响的器官不同,这些疾病会有不同的表现,并被视为综合征。据估计,每10万人中有12人患有某种线粒体疾病。线粒体疾病通常出现在儿童早期并会导致严重症状,比如智力迟钝、心力衰竭和节律紊乱、痴呆、运动障碍、中风样发作、耳聋、失明、眼睛活动受限、呕吐和癫痫等。
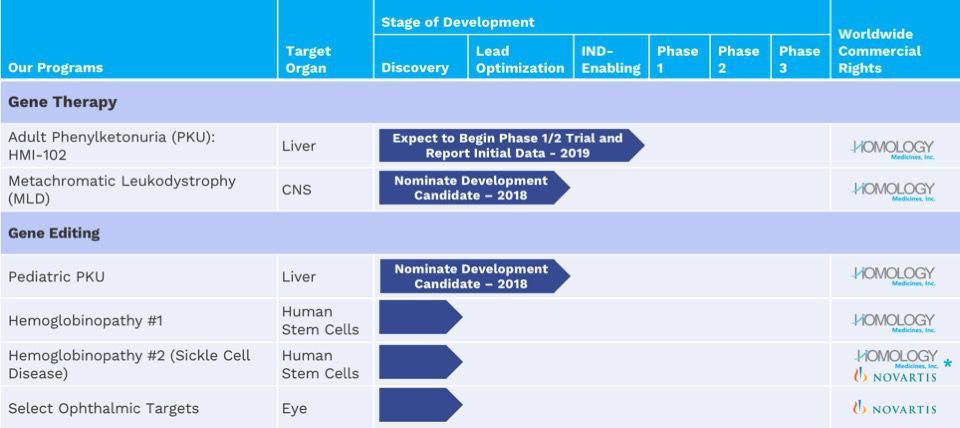
13、异染性脑白质营养不良(MLD)
Homology公司专有载体有潜力治疗异染性脑白质营养不良
图片:Homology Medicines 官网
Homology Medicines公司近日宣布的数据证明:公司专有载体能够穿过血脑屏障,并对罕见神经疾病异染性脑白质营养不良(MLD)产生积极影响。在2018年神经科学学会(SfN)年会上的介绍报告了Homology公司15个人源腺相关病毒载体(AAVHSCs)中3个的生物分布数据。在一个大的物种中,单次静脉注射(IV)后,AAVHSCs表现出多种周围神经和中枢神经系统组织和细胞类型的转导。此外,在临床前MLD模型中,单次静脉注射一种载体可导致30-115%的正常人类ARSA酶活性水平,超过既定10-15%的治疗靶点。Homology公司计划本季度指定MLD候选开发产品,并于2019年开始支持进行新药临床研究(IND)申请的研究。
MLD是一种由ASA基因突变引起的罕见溶酶体贮积症。ASA负责产生芳基硫酸酯酶A(ARSA)蛋白质,这是细胞组分分解所必需的。在MLD中,这些细胞组分会在周围和中枢神经系统中积聚并破坏产生髓磷脂的细胞,导致进行性和严重的神经系统恶化。据估计,每4万人中有1人患有这种晚期婴儿型疾病,患者通常在发病后5到10年内离世。
14、CDKL5缺乏症
Ovid公司荣获CDKL5缺乏症群体“与众不同公司奖”

图片:Ovid Therapeutics 官网
Ovid Therapeutics公司近日宣布因启动OV935/TAK-935 2期试验和对CDKL5缺乏症(CDD)患者群体的承诺而获得2018年CDK15论坛“与众不同公司奖”(Company Making a Difference Award)。CDKL5论坛是关于CDD的科学和治疗发展的最大年度会议。
CDD是一种罕见、严重的神经疾病,患者在出生后几个月内就会频繁发生治疗抵抗性癫痫。CDD会导致一系列严重挑战,包括发育迟缓和智力障碍、运动障碍、睡眠困难、脊柱侧弯、视力障碍、小头畸形和各种胃肠道问题。目前还没有获得FDA批准的治疗方法。
ARCADE试验是一项2期、多中心、非盲先导研究,该研究是与武田制药公司全球合作的一部分,旨在评估OV935对2到17岁伴有CDD或Duplication 15q(Dup15q)综合征相关癫痫发作儿科患者的治疗。首批患者已经招募进入ARCADE。
OV935/TAK-935是一种强效、高选择性和首创的胆固醇24-羟化酶(CH24H)抑制剂,正在被研究作为抗癫痫药物(AED)。OV935是目前临床开发中唯一拥有这种作用机制的分子。OV935是一种试验性药物,尚未获批用于商业用途。FDA授予OV935治疗Dravet综合征和LGS的孤儿药资格认定。
15、天使综合征
OV101治疗天使综合征的2期STARS临床试验
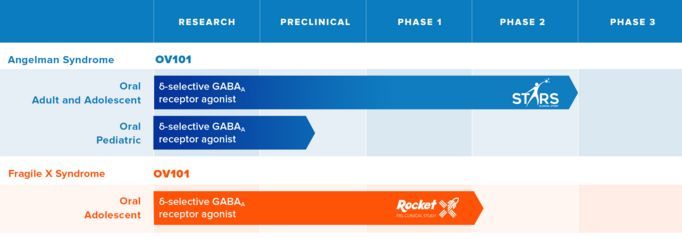
图片:Ovid Therapeutics 官网
Ovid Therapeutics公司最近宣布了来自对2期STARS试验分析的额外探索性有效性数据,新数据进一步支持OV101的潜力。OV101是一种新型选择性GABAA受体激动剂,正在被研究用于治疗天使综合征(Angelman syndrome)。
天使综合征是一种罕见遗传病,其特征是运动和平衡问题、发育迟缓、智力障碍、严重言语障碍、癫痫、睡眠障碍和焦虑。据估计,每15000人中有1人患有该病。天使综合征的遗传病因可以追溯到泛素蛋白连接酶E3A(UBE3A)基因突变和其他破坏。最初体征通常是发育迟缓,比如6到12个月大时缺乏爬行或行走能力。由于和其他疾病的相似性,该病经常被误诊。目前尚无获得FDA批准的治疗药物或确立的治疗模式。
参考资料:
1.https://www.disarmtx.com/news-2/disarm-therapeutics-presents-new-data-validating-role-of-sarm1-in-axonal-degeneration
2.https://cushingsdiseasenews.com/2018/11/06/fda-oks-high-resolution-mri-better-spotting-pituitary-tumor-cushings/
3.https://investors.strongbridgebio.com/news-releases/news-release-details/strongbridge-biopharma-plc-enters-agreement-novo-nordisk-acquire
4.https://www.bmc.org/news/press-releases/2018/11/09/new-more-accessible-staging-system-developed-predict-survival
5.https://investors.abeonatherapeutics.com/press-releases/detail/137/abeona-therapeutics-and-regenxbio-announce-worldwide
6.https://www.prnewswire.com/news-releases/mirum-pharmaceuticals-secures-120-million-in-series-a-financing-to-develop-phase-3-ready-maralixibat-for-rare-liver-diseases-300745243.html
7.http://investors.alnylam.com/news-releases/news-release-details/alnylam-presents-updated-phase-12-open-label-extension-ole
8.http://investors.alnylam.com/news-releases/news-release-details/alnylam-expands-alnylam-actr-program-improve-diagnosis-primary
9.https://www.dailymail.co.uk/health/article-6429733/Teaching-body-fight-glandular-fever-reduce-MS-symptoms.html
10.http://amyloidosis.org/fda-approves-two-treatments-for-hattr-amyloidosis-in-2018/
11.https://www.sciencedaily.com/releases/2018/11/181112191652.htm
12.https://www.homologymedicines.com/news-story/homology-medicines-presents-data-on-platforms-ability-to-target-the-central
13.http://investors.ovidrx.com/phoenix.zhtml?c=254470&p=irol-newsArticle&ID=2372757
14.http://investors.ovidrx.com/phoenix.zhtml?c=254470&p=irol-newsArticle&ID=2373481
本文来自罕见病信息网团队,欢迎个人转发分享。其他任何媒体、网站如需转载,须在正文前注明来源中国罕见病。