美国重症肌无力基金会关于重症肌无力临床试验的建议如下
一、预后指标:
1)应该采用MG复合评分量表(MG-Composite)对干预后状况(post-intervention status,PIS)中的改善和恶化进行定义,≥3分视作临床有意义。
2)工作组鼓励对现有的定量评价方法(如INCB-MG)进一步研究,并制定能更好反映PIS中改善和恶化的新量表。
3)在减少激素用量药物的试验中,应该采用剂量时间曲线下面积(area under dose time curve,AUDTC)或重复测量分析(repeated measures analysis)来对激素暴露情况进行定量;可以采用“延迟开始”的方法,即只有到减少激素用量的药物预计起效时间才开始测量AUDTC。
4)所有使用激素的试验均应该积极监测激素的不良反应,并将其作为试验的预后指标之一。
5)不同的试验中采用统一的激素减量方案很困难,要根据具体的试验设计调整。
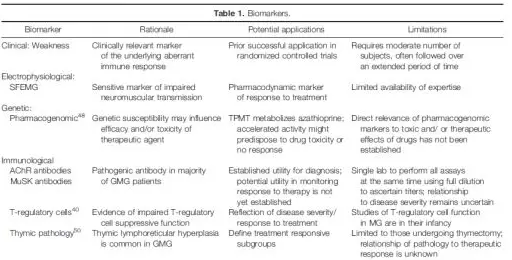
二、生物学标志物:
1)MG研究中需要优先进行的是明确能够反映药物治疗机制和监测疾病活动性的生物学标志物,有助于生物学标志物研究的方法包括将生物学标志物整合到临床试验中,并建立从临床试验被试者中取得的生物标本库。
2)目前已知单纤维肌电图是监测MG疾病活动的最佳生物学标志物,由于该检查所需技术难于被广泛掌握,所以限制了其应用;单纤维肌电图最适合小规模探索性研究(Table 1)。
三、试验的组织工作:
1) 工作组建议建立多个单位的联系,这些单位需要有成功纳入MG患者的经验,以保证储备足够的病源;要保证分中心数目超过试验计划时预期的数量,而非在入组困难时再考虑增加中心数目;事先确定如果发生入组困难,试验进行到何时要增加新的中心或者何时修改入组标准。
2) 研究者要努力扩展试验的入组和排除标准,以保证试验人群尽可能代表需要治疗的人群。
3) 对旨在减少激素剂量的试验要给予足够的试验时间以保证能够显示出减少激素剂量的效果。
4) 在患者纳入临床试验前需要事先考虑到胆碱酯酶抑制剂的剂量,并且将从服用胆碱酯酶抑制剂至临床评价的时间间隔作为统计分析的一个变量。
5) 试验方案应该考虑在MG临床试验早期合用免疫抑制剂,只要能够及时停用以减少其对预后的混杂影响即可。
6) 研究者和试验的申办方应该及时发表临床试验的结果。
7) 试验的申办方应该在试验完成后且主要结果发表后允许共享试验数据。
8)应该建立汇集和共享已经完成的试验数据的机制。
四、药物选择:
需要无偏倚、透明的、科学的复习过程,才能选择出优先进行临床试验的药物。
五、试验设计:
1)在未来的MG随机对照试验的设计中可以考虑采用可调整设计方法(adaptive design approach)。
2)应该在MG l临床试验和注册登记中制定所需的通用数据元素(common data elements,CDE)。
3)要考虑到均数回归趋势(regression to the mean)现象的潜在影响和/或采取积极方法减少该效应的影响。
六、非临床试验策略:
应该建立MG注册登记(MG Registry)系统,前瞻性评价登记患者的病情改变,其中许多资料可以提供进一步研究的机会。
参 考 文 献:
[1] Benatar M,Sanders DB,Burns TM,et al.Recommendations for myasthenia gravis clinicaltrials.Muscle Nerve,2012,45:909-917.
[2] 李海峰,高翔.美国重症肌无力基金会关于重症肌无力临床试验的建议.中国神经免疫学和神经病学杂志,2013,20:74.