
创意制图/新京报记者 王远征
当前,横亘中国罕见病患者面前最大的困难是罕见病药物的可及性问题。2月28日,在国际罕见病日北京发布会上发布的《中国罕见病药物可及性报告(2019)》(以下简称“报告”)指出,我国罕见病患者普遍缺乏治疗药品,或者缺乏及时且足量的治疗,这些对患者身心的损伤常常是不可逆的。在严重的疾病负担下,患者因病致残、因病致贫、因病返贫现象仍较为普遍。
该报告由罕见病发展中心(CORD)与IQVIA艾昆纬中国联合发布。
42%的罕见病患者未接受任何治疗
报告显示,在国家《第一批罕见病目录》纳入的121种罕见病中,74种罕见病在美国、欧盟、日本等有以之为适应证的治疗产品上市销售。而在中国,上述74种罕见病中,9种在中国无药,22种在国内有药但存在超适应证使用情况,13种有治疗药品但未纳入医保,部分药品即使被纳入医保也面临准入障碍。
罕见病发展中心主任黄如方介绍,2014年-2018年,罕见病发展中心对5810名罕见病患者开展登记注册,统计结果显示,42%的患者没有接受任何治疗,而在接受治疗的患者中,绝大部分未能及时且足量地服用治疗药品;一半以上的患者因病致残,其中29%的患者为肢体残障,15%为多重残障(即同时有两种以上残障类型);80%的患者家庭年收入低于5万元,超过一半的患者每年在疾病治疗上的花费占据家庭年收入的80%,远远超过世界卫生组织定义的40%的安全阈值,成为灾难性支出。
对于罕见病患者及家庭来说,贫困和疾病交织,严重的疾病负担与艰难的社会融合形成了难以打破的恶性循环。
162种罕见病药物仅83种中国上市
报告指出,截至2018年12月,《第一批罕见病目录》中74种罕见病在美国或欧盟、日本有以这74种罕见病为适应证的药品获批上市并产生实际销售。具体来说,74种罕见病在全球共上市162种治疗药品(以化学分子实体计)。在这162种治疗药品中,有83种(51%)已在中国上市,可治疗53种罕见病。但在中国明确以罕见病适应证注册的药品仅有55种,仅涉及31种罕见病。在这55种药品中,仅有29种药品被纳入国家基本医疗保险、工伤保险和生育保险药品目录(以下简称“国家医保目录”),涉及18种罕见病。
此前,罕见病药物的上市面临诸多阻碍:首先,罕见病药物对应的患者群体数量少,企业很难判断收益,因此也缺乏研发、仿制及生产罕见病药物的动力;其次,注册准入环节投入不确定,为开展临床试验所需要投入的时间和资源无法预判;此外,部分类别的药物还存在政策不明确的问题。
而医保支付环节也存在“不确定”性,如果没有明确的罕见病保障机制,能够支付得起药物治疗费用的患者数量将更加有限。对于定价高昂的罕见病药物,国外制药企业进入中国保持高价还要面临着道德拷问和伦理困境。在不确定的市场环境下,制药企业往往选择沉默。
2015年以来,我国政府已出台《关于改革药品医疗器械审评审批制度的意见》等多项政策措施,力图打破笼罩在罕见病药物上的“市场不确定”,鼓励罕见病用药的引进、研发和生产,并加快罕见病药物的注册审评审批。但报告指出,缺乏罕见病药物身份认定及独立的罕见病药物注册审评审批通道,仍是影响罕见病药物可及的隐形障碍。
此外,罕见病药物在国内的引进、注册和上市,还需要一系列配套政策法规的落地。如原卫生部于1986年发文称,除了人血清白蛋白外,禁止进口血液制品。对于首批罕见病目录中以血液制品为主要预防和治疗方案的罕见病,这一规定仍有负面影响,如治疗卟啉病的人血红素,患者不得不通过海外代购获得,不受监管的运输条件也给患者带来了巨大风险。
21种罕见病面临“境外有药 境内无药”困境
报告显示,包括法布雷病、亨廷顿舞蹈病、黏多糖贮积症等在内的21种罕见病面临“境外有药、境内无药”的困境(报告统计时间截至2018年12月底)。这其中,有9种药物已经在2018年优先审评审批申请上市中。值得高兴的是,2月25日,这9种优先申请审批的药物中,脊髓型肌萎缩症(SMA)的治疗药物获批上市,该药从提交上市申请到获批上市,只花了不到6个月的时间。
另有包括苯丙酮尿症在内的3种罕见病可以通过特配奶粉等饮食控制方式适当缓解。但仍有包括镰刀型细胞贫血病等在内的9种罕见病的患者在“境内无药”的困境中等待希望。
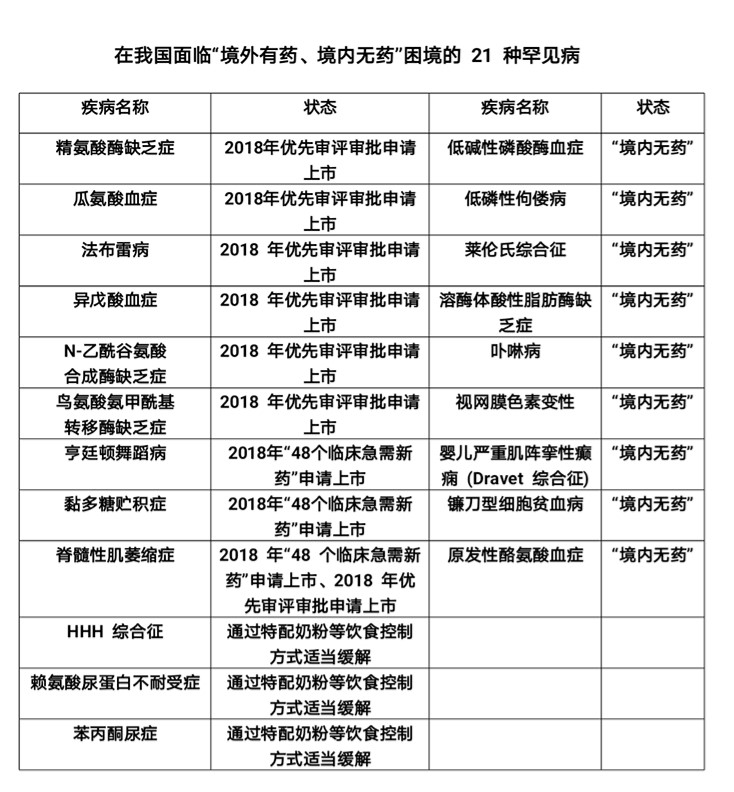
图片来源/《中国罕见病药物可及性报告(2019)》提供
22种罕见病药物存在超适应证使用现象
报告指出,《第一批罕见病目录》中,包括进行性肌营养不良、家族性地中海热等在内的22种罕见病涉及的20种药品,虽已在我国上市却并没有注册相应罕见病适应证,这意味着它们在原则上并不能被用于治疗这22种罕见病。“超适应证使用”、“老药新用”、“试验性疗法”,在罕见病药物可及性有限的情况下,是临床医生和研究者不得已开辟的新途径。
然而,超适应证处方对患者、医生和医院都存在较大风险。为什么药品的生产企业不在中国申请相关罕见病适应证?
多名临床医生提到,许多成熟药品难以满足中国当下注册审评审批制度中对药品制剂的要求。“用今天的制剂标准,去要求一个在国外已经上市十多年的药品补做临床试验,常常是不合理的。”此外,许多“老药新用”的成熟药皆已过专利保护期,随着仿制药的出现,原研和仿制药生产企业为药品补做临床试验申请新适应证的动力都不足。
13种罕见病药物缺乏医保支付
目前已经在中国上市且有罕见病适应证的55种药品中,有29种药品被纳入国家医保目录,涉及18种罕见病。这29种药品中,有9种享受国家医保目录甲类报销,用于治疗11种罕见病适应证,患者使用时无需自负。
但另外26种药品,涉及21种罕见病,尚未被纳入国家医保目录。其中,有13种罕见病,涉及的所有治疗药品,均未被纳入我国医保目录。这意味着这13种罕见病的患者必须自费承担全部的药品治疗费用。在这13种罕见病的药品治疗花费中,年治疗费用高的近500万元,低的则仅需189元,中位值为20万元。这13种罕见病在我国约影响23万名患者,大部分人需要终身用药治疗。其中,有11种治疗药品的年治疗费用大于8万元人民币,在没有医保支付的情况下,患者难以维持长期足量和足疗程的治疗。
除了医保目录准入,罕见病药品在一系列市场准入环节上,比如:省级药品招标采购、医院采购列名、医师处方限制、门诊报销、分级诊疗、定点医疗机构和药店限制等,仍然存在很大的不确定性。价格高昂的罕见病药品面临上市难、支付难的问题,而价格过低的药品则面临断供甚至停产危机,对患者而言,明明有药却用不上,其痛苦不言而喻。
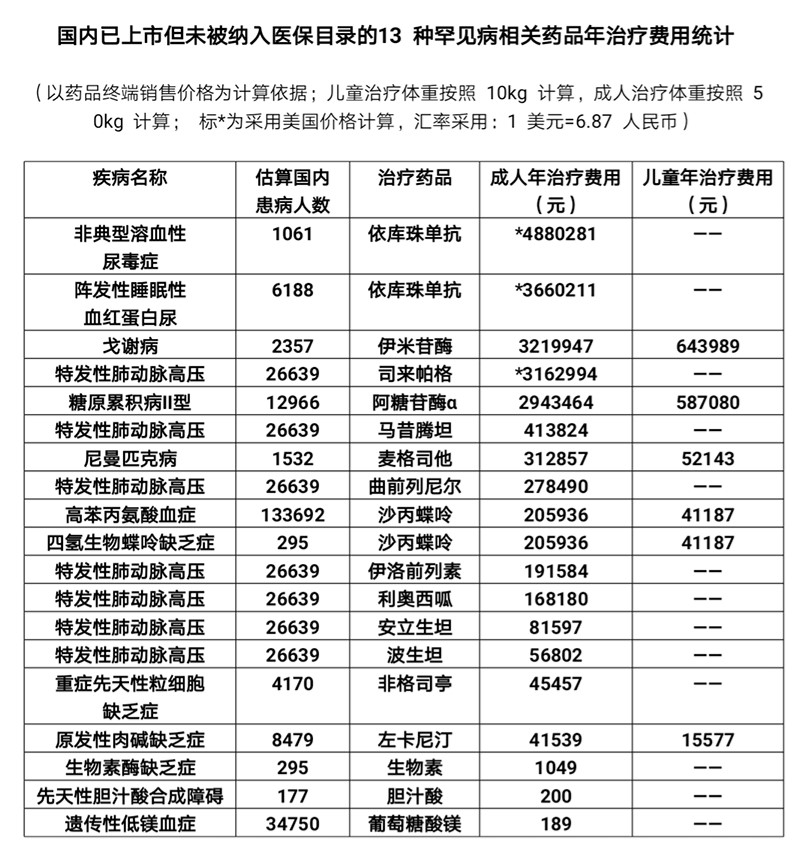
图片来源/《中国罕见病药物可及性报告(2019)》提供
提升罕见病药物可及性需制定“国家计划”
在越来越多的国家和地区,罕见病被纳入公共治理的范畴,通过政府干预,帮助患者解决药物不可及的问题。考虑到罕见病背后的社会公平与效率问题、医学科学发展问题和医药产业创新等问题,欧盟、法国、德国、意大利、英国、巴西、印度、澳大利亚等越来越多的国家和地区开始将罕见病议题上升到国家层面,制定罕见病国家战略或国家计划。
报告指出,在目前实施罕见病药品保障的国家和地区,本质上都是基于体制及资源,从罕见病治疗可及的不同环节为切入点,采取本地化的管理模式。这其中,共性的管理模式包括,通过立法定义罕见病或罕见病药品,设立鼓励创新、系统化、差异化的罕见病新药注册审批审评制度,搭建由政府主导、医保覆盖、多方共付的罕见病药品保障体系,为罕见病药品设立差异化的医保准入评估体系和卫生技术评估体系,同时降低甚至免除罕见病患者的自负费用。
以美国为例,在1983年《孤儿药法案》出台前的10年里仅有10种罕见病药品上市,而1983年后,获得“孤儿药”身份认定的503种药品成功上市,涉及731种适应证(截至2018年9月)。2017年,在美国上市的42种新药中,有一半是罕见病药品。
罕见病药物创新鼓励政策也将促进产业发展。2018年全球市场销售金额排名前10的药品中,有8个已在美国获得“孤儿药”身份认定,其中有4个药品是以“孤儿药”身份上市并逐渐扩展多个罕见病或非罕见病适应证,而全球销售排名第二的来那度胺在美国获批的所有适应证都是罕见病且获得了“孤儿药”身份认定。
为此,报告指出,大量实践经验表明,从国家层面系统解决罕见病药物可及性问题,不仅可以促进产业发展,对医疗保障基金影响有限且可控,同时还能显著提升全民健康获得感。建议我国政府以罕见病患者利益和国家利益为中心,以构建可持续发展的创新行业生态环境为发展方向,尽快制定“罕见病国家行动计划”,围绕罕见病的基础研究、药品研发、仿制与生产和医疗保障,构建可持续的创新和发展生态环境。