1. 纯合子家族性高胆固醇血症
JUXTAPID® 商业化达成独家许可协议
图片:juxtapid.com
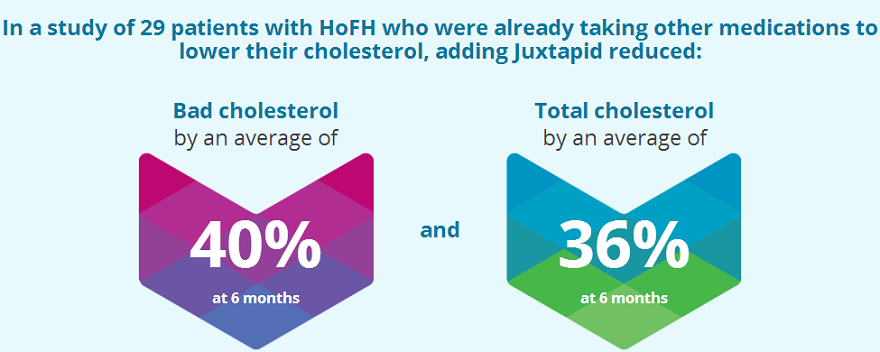
Novelion Therapeutics公司近日宣布其子公司Aegerion Pharmaceuticals与Recordati Rare Diseases公司就JUXTAPID®(lomitapide)在日本的商业化达成独家许可协议。该协议包括Recordati在日本商业化JUXTAPID以治疗当前获批适应证纯合子家族性高胆固醇血症(homozygous familial hypercholesterolemia,HoFH)的独家权利,如果Aegerion公司发现潜在新的适应证,Recordati还拥有在日本针对新适应证进行产品商业化的最初独家谈判权
2016年9月,JUXTAPID获得日本厚生劳动省(MHLW)批准用于治疗HoFH患者。HoFH是一种严重的罕见遗传病,会损害负责清除体内低密度脂蛋白胆固醇(LDL-C,“坏”胆固醇)的受体功能。LDL受体功能丢失会导致血液胆固醇水平极度升高。HoFH患者常发展为早期和进行性动脉粥样硬化,即动脉狭窄或阻塞。
2. 腓骨肌萎缩症
FDA授予PXT3003快速通道资格认定

Pharnext SA公司近日宣布:FDA授予其开发PXT3003治疗1A型腓骨肌萎缩症(Charcot- Marie-Tooth disease Type 1A,CMT1A)的快速通道资格认定。
Pharnext公司于2015年12月启动了PLEO-CMT研究,这是一项为期15个月的关键、双盲、3期试验,评估PXT3003治疗323名16-65岁CMT1A患者的有效性和安全性。2018年10月,公司宣布PXT3003达到FDA和欧洲药物管理局(EMA)认可的预先指定的主要终点:总体神经病变限制量表(ONLS)与安慰剂相比统计上显著的差异(p=0.008)。Pharnext公司还于2017年3月启动了为期9个月的非盲扩展研究PLEO-CMT-FU,该研究正在进行之中,招募完成PLEO-CMT研究的患者,旨在评估PXT3003的长期安全性和耐受性。
PXT3003是一种巴氯芬、纳曲酮和山梨醇的新型协同作用固定剂量组合,作为口服溶液剂用药,每日两次。该药物获得欧盟和美国的孤儿药资格认定,在治疗CMT1A的临床前和2期研究中显示出积极结果。
3. 法布雷病
FDA接受ST-920的新药临床研究申请
图片:Sangamo 官网
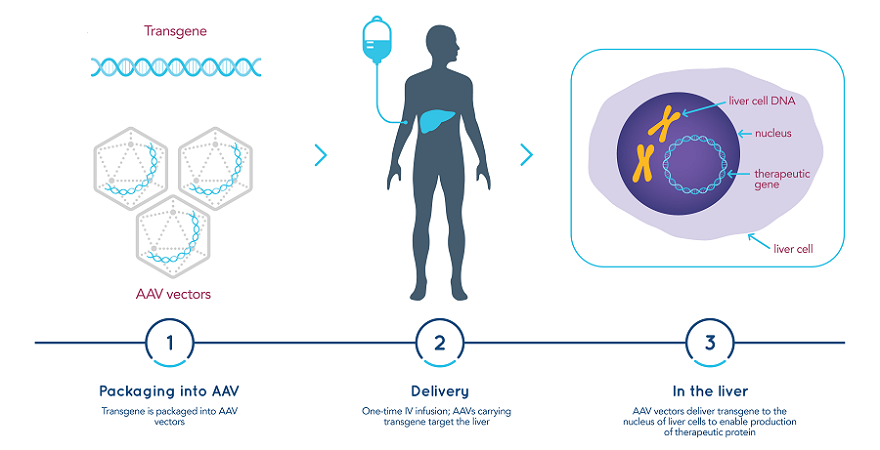
Sangamo Therapeutics公司最近宣布,FDA接受其候选基因疗法ST-920治疗法布雷病(Fabry disease)的新药临床研究申请(IND)。
法布雷病是一种因GLA基因突变造成α-半乳糖苷酶A(α-Gal A)缺乏而导致的罕见、遗传性代谢病。在缺乏功能性α-Gal A酶的情况下,被称为神经酰胺三己糖苷(Gb3)的脂肪化合物会积聚并严重损害皮肤、肾脏、心脏和神经系统。目前的标准治疗为终生定期输注酶替代疗法(ERT)。
ST-920包括携带GLA基因结构的AAV载体,该基因结构由专有的肝脏特异性启动子驱动。ST-920基因疗法旨在使得患者肝脏能够长期持续地产生α-Gal A酶。Sangamo公司计划启动一项1/2期临床试验,评估ST-920治疗法布雷病成人患者的安全性、耐受性和有效性。预计今年晚些时候将开放几处临床试验地点。
4. Dravet综合征
Zogenix公司提交Dravet综合征的新药上市申请
Zogenix公司最近宣布分别向FDA和EMA提交批准FINTEPLA(ZX008,低剂量氟苯丙胺)治疗Dravet综合征(Dravet syndrome)相关癫痫发作的新药上市申请(NDA)和上市许可申请(MAA)。
这两项申请都以来自两项治疗Dravet综合征关键3期临床试验的数据以及一项正在进行的非盲扩展研究的中期分析数据为基础。Zogenix公司还在研究FINTEPLA治疗另一种罕见的儿童期癫痫Lennox-Gastaut综合征,目前正在进行3期试验。
Dravet综合征是一种始于婴儿期的罕见顽固性(难治性)癫痫,与频繁、严重和潜在危及生命的发作、发育迟缓、认知障碍以及癫痫猝死(SUDEP)风险升高相关联。Dravet综合征的发病率之前估计为1/40000-1/20000。不过,最近的研究表明这一比例可能达到1/15700。该病会影响患儿整个家庭,经常导致大量的经济、生理和心理问题。
5. 儿童交替性偏瘫
FDA授予XEN007治疗儿童交替性偏瘫的儿科罕见病资格认定

图片:Xenon 官网
Xenon Pharmaceuticals公司近日宣布:美国食品与药物管理局(FDA)授予XEN007(活性成分氟桂利嗪)治疗儿童交替性偏瘫(Alternating Hemiplegia of Childhood,AHC)的儿科罕见病(RPD)资格认定。FDA将RPD资格认定授予主要影响18岁及以下儿童、美国患者少于20万人的严重和危及生命的疾病。
Xenon公司首席执行官Simon Pimstone博士说:“获得FDA的RPD资格认定是我们XEN007项目的重要里程碑,突显了为AHC找到治疗方法的迫切性。”
AHC是一种罕见而危及生命的毁灭性神经疾病,对患者日常功能有重大影响。AHC的表现包括反复发作的半身不遂或四肢瘫痪,阵发性障碍包括强直性或张力障碍性姿势异常,发育恶化和神经功能异常,这些症状最初都会在18个月大之前出现。据估计,美国可能有3200名AHC患者,尽管该病非常严重,但目前还没有获批的治疗药物。
6. 原发性HLH
emapalumab新数据突显治疗效果
Swedish Orphan Biovitrum AB公司和Novimmune SA公司最近在移植和细胞疗法(TCT)会议上公布了emapalumab-lzsg治疗原发性噬血细胞性淋巴组织细胞增多症(haemophagocytic lymphohistiocytosis,HLH)患者2/3期临床研究的最新数据。这些数据检测了接受emapalumab治疗并进行造血干细胞移植(HSCT)的原发性HLH患者的预后。
Emapalumab是一种阻断干扰素y(IFNy)的抗体,获得FDA批准用于难治性、复发性或进行性或者不耐受常规HLH疗法的儿科(新生儿和更大龄儿童)和成人原发性HLH患者的治疗,商品名为Gamifant®。
原发性HLH是一种罕见、进展迅速、经常致命的过度炎症综合征,IFNy的大量分泌被认为会驱动该病中的免疫系统过度激活,最终导致器官衰竭。据估计,美国每年确诊的原发性HLH病例不到100例。由于体征和症状的多样性,可能包括发烧、肝脾肿胀、红细胞和白细胞计数严重减少、出血、感染、神经症状、器官功能障碍和器官衰竭等,该病的诊断颇具挑战性。如果不及时治疗,原发性HLH会迅速致命,中位生存期不到两个月。
7. 轻链淀粉样变
Alexion与Caelum公司合作开发靶向疗法
Alexion Pharmaceuticals和Caelum Biosciences公司近日宣布合作开发CAEL-101,用于治疗轻链淀粉样变(light chain amyloidosis)。CAEL-101是一种首创的淀粉样蛋白纤维靶向疗法,旨在通过减少或消除轻链淀粉样变患者体内的淀粉样蛋白沉积物而改善器官功能。
CAEL-101是一种首创单克隆抗体(mAb),旨在通过减少或消除轻链淀粉样变患者组织和器官中的淀粉样蛋白沉积物而改善器官功能。CAEL-101已经获得FDA授予治疗轻链淀粉样变的孤儿药资格认定,并作为轻链淀粉样变患者的放射显像剂。
轻链淀粉样变是一种由骨髓浆细胞异常导致的罕见系统性疾病。浆细胞产生的错误折叠免疫球蛋白轻链会聚合并形成原纤维,沉积在组织和器官中,逐渐影响它们的功能。该病会导致进行性和广泛的器官损害和高死亡率,最常见的死亡原因是心力衰竭。
8. 肢带型肌营养不良症
MYO-101基因疗法治疗的临床试验新数据

图片:Sarepta Therapeutics官网
前不久,Sarepta Therapeutics公司宣布了来自3名接受MYO-101治疗的2E型肢带型肌营养不良症(Limb-girdle muscular dystrophy Type2E,LGMD2E)临床试验参与者的积极结果。MYO-101是一种新型基因疗法,目的是利用编码全长天然β-SG蛋白的基因来转变骨骼肌和心肌,缺乏这种蛋白会导致LGMD2E。LGMD2E是一种常染色体隐性遗传的肌营养不良症,患者在10岁前开始出现神经肌肉症状,比如奔跑、跳跃和爬楼梯困难,青少年时期会发展为失去行走能力,通常在30岁之前离世。该病目前无法治愈。
MYO-101使用AAVrh74载体,设计为能够被系统而有力地递送到骨骼肌、膈肌和心肌而不随意穿过血脑屏障,使其成为治疗周围神经肌肉疾病的理想候选疗法。这项首次在人类中进行的1/2a期基因转移临床试验正在评估MYO-101单次静脉输注对4-15岁有明显症状的LGMD2E患儿的治疗情况。
LDMD是一种会导致进行性、衰弱性肌肉无力和萎废的遗传病,开始于臀部和肩部周围肌肉,随后会发展到手臂和腿部。Sarepta公司正在开发5个LGMD基因疗法项目,包括LGMD2E、LGMD2D、LGMD2C、LGMD2B和LGMD2L。
9. 黏多糖贮积症II型
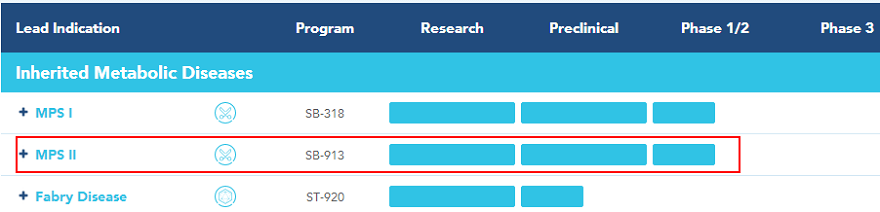
SB-913中期研究新数据
图片:Sangamo官网
前不久,Sangamo Therapeutics公司报告了人类基因组体内编辑的初步分子和酶证据。这些发现是1/2期CHAMPIONS研究中期结果的一部分,该研究正在评估锌指核酸酶(ZFN)体内基因组编辑候选产品SB-913对黏多糖贮积症II型(Mucopolysaccharidosis Type II,MPS II)患者的治疗状况。公司还报告了评估SB-318治疗MPS I患者的EMPOWERS研究中期结果。
MPS II也被称为Hunter综合征,是一种因艾杜糖醛酸-2-硫酸酯酶(IDS)缺乏而导致的罕见遗传病。IDS是一种分解或回收糖胺聚糖(GAGs)毒性团块所需的溶酶体酶。如果没有IDS酶活性,GAGs就会在全身细胞中积聚,导致广泛的组织和器官损伤。目前MPS II的标准治疗是每周静脉输注酶替代疗法(ERT)。
10. 黏多糖贮积症IIIA型
LYS-SA302基因疗法2/3期临床试验完成首名患者给药

图片:Sarepta Therapeutics官网
Lysogene和Sarepta Therapeutics公司近日宣布AAVance试验完成首名患者的给药。AAVance一项LYS-SAF302基因疗法治疗黏多糖贮积症IIIA型(Mucopolysaccharidosis Type IIIA,MPS IIIA)的全球2-3期临床试验。
AAVance是一项单臂试验,旨在评估携带N-磺基葡萄糖胺磺基水解酶(SGSH)基因的重组腺相关病毒载体rh.10一次性递送的有效性。MPS IIIA由SGSH基因突变导致,SGSH基因参与产生一种分解和处理长链糖分子所需的酶。LAF-SAF302的目的是提供SGSH基因的功能拷贝,使得大脑能够分泌所缺失的酶。该试验将在美国和欧洲8个地点招募20名患者。
MPS IIIA是一种罕见的遗传性神经退行性溶酶体贮积症,大约每10万新生儿中有1人受其影响。该病为常染色体隐性遗传模式,其特征是难以处理的行为问题和发育退化导致早亡。
Sanfilippo综合征
最近,Bioblast Pharma公司宣布与非营利组织Team Sanfilippo建立临床合作,以评估Bioblast公司专有海藻糖溶液治疗Sanfilippo综合征(Sanfilippo syndrome,或称为MPS-III)的安全性和有效性。
海藻糖是一种低分子量二糖,既是蛋白质稳定剂,也能激活自噬。被证明能够渗透肌肉并穿过血脑屏障。在之前的2期临床研究中,海藻糖已经治疗了70多名患有两种罕见病的患者,整体是安全有效的。
11. Alport综合征
基于小鼠研究报告的新数据
最近一项研究报告,针对血管内皮细胞的靶向基因疗法未能恢复Alport综合征(Alport syndrome)小鼠模型中正常胶原蛋白的生成。
Alport综合征是一种以进行性肾病为特征的遗传病,可导致肾功能衰竭。该病由COL4A3、COL4A4或COL4A5基因突变引起,这3个基因指示4型胶原蛋白(COL4)不同亚基的构建,而COL4是结缔组织的主要成分。目前Alport综合征的治疗重点是尽量减少与肾病相关的负面影响,而无法解决其原发性病因。基因疗法是少数几种可能解决和纠正Alport综合征原发性病因的实验方法之一。
在之前的一项研究中,华盛顿大学医学院研究人员表明,在设定的时间点迫使COL4A3在所有细胞中表达或者特异性在足细胞中表达,可以成功阻止Alport综合征(COL4A3 -/- 小鼠)模型的疾病进展。
在这项新研究中,同一组研究人员着手在Alport综合征小鼠模型肾脏内皮细胞中测试COL4A3靶向基因疗法的治疗潜力。研究人员诱导缺乏功能性COL4A3基因的小鼠肾脏内皮细胞特异性产生人工COL4A3。
12. 亨廷顿舞蹈症
RG6042(IONIS-HTT Rx)的关键研究招募首名患者
图片:Ionis Pharmaceuticals官网
最近,Ionis Pharmaceuticals公司宣布,其合作伙伴罗氏公司(在美国也被称为基因泰克公司)RG6042(IONIS-HTTRx)治疗亨廷顿舞蹈症(Huntington's disease,HD)患者症状的关键研究招募首名患者。HD是一种遗传性神经退行性疾病,目前还没有获批的疾病修饰疗法。RG6042是关键试验中的首种疗法,旨在通过减少毒性突变huntingtin蛋白(mHTT)的产生而靶向HD基础病因。Ionis公司获得了3500万美元的里程碑式支付以启动这项研究
HD是一种毁灭性、最终致命的遗传病,会导致患者智力和身体控制能力退化。美国大约有3万人罹患HD并有症状,超过20万人面临遗传风险。
罗氏和Ionis公司正在合作开发反义药物来治疗HD。2017年12月,罗氏从Ionis公司获得IONIS-HTTRx许可并将这种研究性分子重新命名为RG6042。2018年10月,Ionis和罗氏公司宣布合作开发IONIS-FB-LRx(一种利用Ionis公司先进配体共轭反义技术的反义药物)用于治疗补体-介导疾病。
13. 高血氨症
SYNB1020潜在疗法的临床数据信息

图片:Synlogic 官网
Synlogic公司近日宣布,在《科学•转化医学》(Science Translational Medicine)上发表了其研究性生物合成候选药物SYNB1020的临床前数据,这是基于对健康志愿者中进行的1期临床研究数据和支持性临床前数据。这些数据支持继续开发SYNB1020。
Synlogic公司正在进行一项治疗肝硬化和血氨升高患者的1b/2a期临床试验,评估SYNB1020对其系统性氨水平的管理,预计将于2019年年中报告相关数据。
高氨血症(Hyperammonemia)是一种以血液中氨过多为特征的代谢疾病。在健康个体中,氨主要是在肠道中作为蛋白质代谢的副产品而产生,随后在肝脏中转化为尿素,并随尿液排出。不过,如果肝脏将氨转化为尿素的能力受到损害,比如因为遗传缺陷(尿素循环障碍)或者后天肝病导致肝硬化,那么氨会在血液中积聚。血氨水平升高对大脑具有毒性,会产生严重后果,包括需要住院治疗的神经危象、不可逆的认知损伤和死亡。
14. Phelan-McDermid综合征
NNZ -2591临床前模型中显示出积极效果

Neuren Pharmaceuticals公司近日宣布,其候选药物NNZ-2591在Phelan-McDermid综合征(Phelan-McDermid syndrome,PMS)临床前模型中显示出积极效果。
PMS是一种因22号染色体22q13区域的缺失或其他改变导致的罕见遗传病,也被称为22q13缺失综合征。PMS最常见的特征是智力障碍、言语迟缓或缺失、自闭症症状(约75%被诊断为自闭症谱系疾病)、肌张力低下、运动迟缓和癫痫。该病目前没有特异性治疗方法。
除了PMS,NSZ-2591还在帕金森病、中风、创伤性脑损伤、周围神经病变、脆性X综合征、记忆障碍和多发性硬化症临床前模型中显示出疗效。
15. 雷特综合征
ACADIA公司宣布3期试验计划
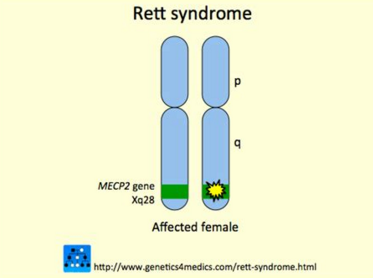
ACADIA Pharmaceuticals公司近日宣布,将于2019年下半年开始trofinetide治疗雷特综合征(Rett syndrome)的3期研究。
CADIA公司计划进行一项为期3个月的3期、双盲、随机、安慰剂对照研究,以评估trofinetide治疗大约180名5-20岁雷特综合征(Rett syndrome)女性患者的有效性和安全性。3期研究之后,将进行一项非盲扩展研究,所有之前3期研究的参与者都将有资格接受trofinetide治疗。在非盲扩展研究中,所有参与者将被随访以评估trofinetide的长期耐受性和安全性。
参考来源:
1.https://ir.novelion.com/news-releases/news-release-details/novelion-therapeutics-subsidiary-enters-licensing-agreement
2. https://www.pharnext.com/en/news/press-releases(PDF版)
3.https://investor.sangamo.com/news-releases/news-release-details/sangamo-announces-fda-acceptance-ind-application-st-920-gene
4.https://zogenixinc.gcs-web.com/news-releases/news-release-details/zogenix-submits-new-drug-application-us-food-drug-administration
5. http://www.xenon-pharma.com/product-pipeline/xen1101-for-epilepsy/
6.http://news.cision.com/swedish-orphan-biovitrum-ab/r/new-emapalumab-data-presented-at-transplantation-and-cellular-therapy--tct--meeting-highlight-post-t,c2749683
7.https://news.alexion.com/press-release/company-news/alexion-and-caelum-biosciences-announce-collaboration-develop-targeted-th
8.http://investorrelations.sarepta.com/news-releases/news-release-details/sarepta-therapeutics-announces-positive-and-robust-expression
9.https://investor.sangamo.com/news-releases/news-release-details/sangamo-announces-interim-results-phase-12-champions-study
10.http://investorrelations.sarepta.com/news-releases/news-release-details/lysogene-and-sarepta-therapeutics-announce-dosing-first-patient
https://ir.bioblastpharma.com/news-releases/news-release-details/bioblast-pharma-announces-collaboration-team-sanfilippo-evaluate
11.https://alportsyndromenews.com/2019/02/25/gene-therapy-aiming-to-restore-col4-protein-not-likely-to-succeed-study-in-mice-reports/
12.http://ir.ionispharma.com/news-releases/news-release-details/first-patient-enrolled-pivotal-study-rg6042-ionis-htt-rx-people
13.https://investor.synlogictx.com/news-releases/news-release-details/science-translational-medicine-publishes-first-human-clinical
14.http://www.neurenpharma.com/irm/content/asx-announcements.aspx?RID=8&RedirectCount=1(PDF版)
15.http://www.neurenpharma.com/irm/PDF/1814_0/PlansforPhase3trialinRettsyndrome(PDF版)