6月20日,国家卫健委药物政策与基本药物制度司发布《第一批鼓励仿制药品目录建议清单》,总计34个药品,包含多个抗癌药和罕见病药物。
该清单为国家卫生健康委联合科技部、工业和信息化部、国家药监局、知识产权局等部门组织专家对国内专利到期和专利即将到期尚没有提出注册申请、临床供应短缺(竞争不充分)以及企业主动申报的药品进行遴选论证,提出了具体清单,公示为5个工作日。
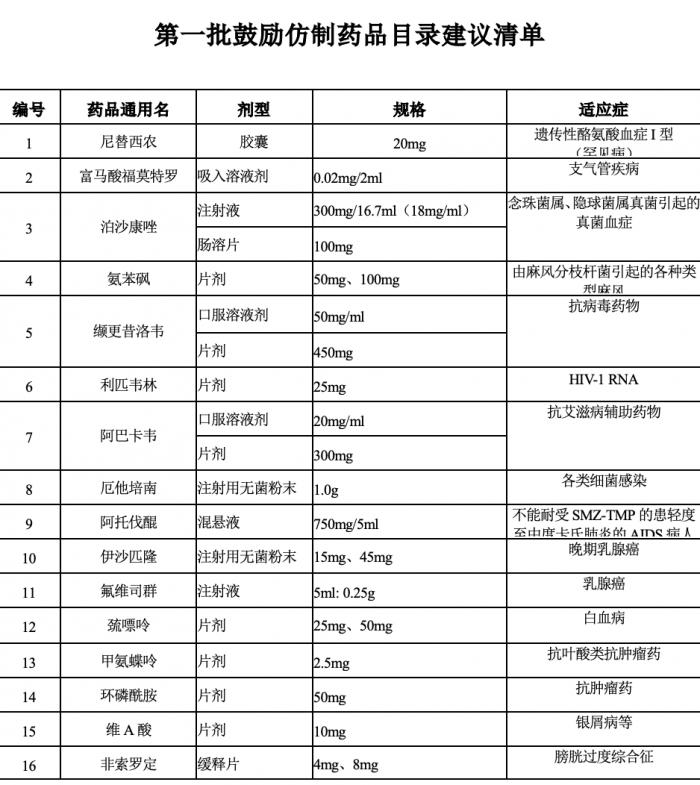
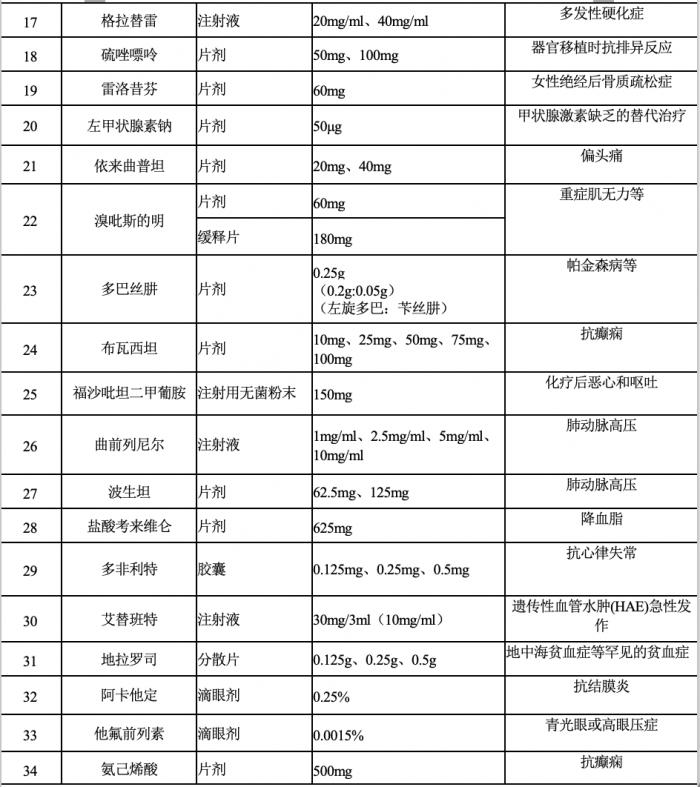
(图源:国家卫健委,适应症为21世纪经济报道记者整理)
抗癌药一向是重点,罕见病药物也成为今年国家重点发力对象。
2月23日,财政部等四部门发布《关于罕见病药品增值税政策的通知》,从3月1日起,对首批21个罕见病药品和4个原料药,国内环节可选择按照简易办法依照3%征收率计算缴纳增值税,进口环节减按3%征收增值税。
由于罕见病的特殊性,单个罕见病病种,无论在新药研发还是临床治疗都面临诸多挑战。很多罕见病认识水平低、误诊率高、药物可及性差;罕见病药物公司也面临着投入高、研发难、上市难的风险;对于一些罕见病患者来说,无药可医、有药价高、难进医保、甚至进了医保可能也买不到药都是常态。
由于药品金贵、价格高昂,鼓励仿制药合情合理。
罕见病不是一种疾病,目前中国尚未有官方的罕见病定义。
各国对罕见病的定义和标准不一:罕见病在美国是患病人数低于20万人的疾病;在欧盟是患病率低于1/2000的疾病;在日本是患病人数低于5万人的疾病。
全世界已知的罕见病约有7000种,按照五十万分之一发病率测算,预估我国罕见病患者总数不低于2500万。
大多数罕见疾病都是遗传性疾病,即使症状没有立即出现,可能会伴随一个人的整个生命。EURORDIS数据称个别罕见疾病可能只影响一百万人中的一人,但所有罕见疾病患者共占欧盟人口的6%至8%。
罕见病的首要困难是难诊断。以脊髓性肌萎缩症(SMA)为例,这是一种被称为“2岁以下婴幼儿头号遗传病杀手”的罕见病,患者脊髓内的运动神经细胞受到侵害后,会逐渐丧失各种运动功能,甚至呼吸和吞咽。
很多儿科医生都对它知之甚少,甚至有些神经科医生也不一定能做出准确诊断,导致误诊率居高不下。一旦不幸确诊,患儿和家庭还将继续面临无药可用的窘境,家长只能从护理和营养上维持和改善患儿的器官功能。
EURORDIS在2008年发起并确定了2月29日为国际罕见病日,四年一次的日子意寓罕见病之“罕见”,后将每年二月的最后一天定为国际罕见病日。
其次的困难是“无药可用”。
治疗罕见病的药物又叫孤儿药,由于患者太少,在正常的市场条件下,无法靠销售回收前期高额的研发投入,制药公司对开发仅针对少数患者的产品几乎没有兴趣。
此前在第七届中国罕见病高峰论坛上,国家卫健委罕见病诊疗与保障专家委员会副主任委员丁洁表示,一方面,对罕见病发病机制研究不足,对治疗靶点的研究也不够;第二,企业对罕见病药物的开发动力不足;第三,由于患病人群少,难以找到足够数量的病人开展相关临床试验,无法满足药品上市的要求。
对此各国在针对孤儿药的研发上都做出了不同程度的鼓励,美国在1983年通过的孤儿药法案对其研发进行了经济上的激励,包括研发成本的50%税收抵免、孤儿药专营权排他性条款等。进而影响了日本在1993年、欧盟在2000年制定了相关的政策。
“中国罕见病整体行业发展起步比较晚,政策上现在还没有一部全国性的罕见病法规。”罕见病发展中心(CORD)创始人、主任黄如方此前在接受21世纪经济报道采访时表示,2009年之前在国内是被忽视的状态,“09年我们引入了罕见病日、做了大量的宣传;09年至2014年期间,是罕见病被广泛关注的时期,孵化出了大量的罕见病患者组织,临床专家也越来越正视罕见疾病患者群体。”
但公众仍然对罕见病有一些误区,如觉得离自己很遥远而不关心,患者太少可以忽略,“还有一些误解觉得罕见病药物都特别贵,一个病人占了很多医疗支出,但罕见病人首先面临的是无药可医,有药用了不能用价格来衡量,应该是用价值来衡量。每一个人都应该有基本的医疗的保障,在价格问题上可以通过多方努力去解决。”
2014年出现了冰桶挑战赛,让渐冻人成为最为著名的罕见病病种。仅在美国就有170万人参与挑战,250万人捐款,总金额达1.15亿美元,这可能是为某种疾病或紧急情况捐助最多的款项。
2015年,中国成立了罕见病专家委员会,“从15年到现在是政策陆续出台的阶段,我乐观估计到2020年,罕见病的产业会得到较大的发展。”
2018年4月,国家卫生健康委员会等5部门联合制定了《第一批罕见病目录》,包含121种罕见病。据不完全统计,仅44个病种有相关药物在全球上市,多数疾病还处于无药可治的状态。10月,药监局发布罕见病防治医疗器械注册审查指导原则。包括依库珠单抗、艾美赛珠单抗等多个罕见病药物加速获批上市。2019年2月,国家卫健委发布了建立全国罕见病诊疗协作网的通知。
“能看出国家对于罕见病问题,特别是患者临床用药是下了决心要解决的。”黄如方说,“督促各个部委如卫健委、药监局、科研系统、医保部门陆续出台一系列政策。”
黄如方认为,可以预见到的是,未来几年,“一是国外的罕见病药物将会井喷式进入中国市场,特别是国家目录里相对应治疗的疾病。二是会激励中国医疗产业对于罕见病药物的防治和创新研发。三是加快罕见病患者的诊断、更加规范的治疗。四是解决患者可及可负担问题,医保部门会在罕见病药品的报销有更明确的举措。”
罕见病药物罕见,价格自然也金贵。
EvaluatePharma《Orphan Drug Report 2018》数据显示,预计从2018年到2024年,全球孤儿药销售将以11.3%的复合年增长率增长,是非孤儿药市场6.4%的两倍;预计到2024年,孤儿药将占全球处方药销售额的五分之一,达到2620亿美元。
尽管最近两年孤儿药的定价增长有所放缓,但2017年每位患者的平均成本仍然达到了147308美元,是非孤儿药的平均成本30708美元的四倍多。
2017年,Revlimid通过了多发性骨髓瘤适应症、获得孤儿药品的资格,Celgene成为拥有最大孤儿药销售量的公司。阵发性夜间血红蛋白尿治疗的年度价格超过50万美元,Soliris成为行业最昂贵的药物。
到2024年,预计肿瘤占比最大的孤儿药物治疗领域,约占50%,血液为第二大治疗领域,其次为中枢神经系统。Celgene也将成为2024年孤儿药市场的领先企业,销售额为184亿美元,如BMS收购新基成功,这一名号也将易主;预计Keytruda将成为2024年的孤儿药销售冠军,销售额为127亿美元,Revlimid滑到第二位,预计销售额为119亿美元。
监管部门也不断出台鼓励措施,往年FDA获批的肿瘤药也是最大头,但今年“孤儿药”强势胜出,59种新药中有34种(58%)是针对罕见疾病的,创下了历史记录。
由此吸引进入行业的玩家也越来越多。2019年1月8日,武田制药完成对罕见病公司夏尔(Shire)的收购,交易金额约624亿美元。
罗氏中国神经学领域临床科学家张巍峰此前在罕见病论坛上表示,2017年罗氏研发总投入106亿美元,其中相当一部分投在罕见病领域。“目前进入临床研发及上市阶段的罕见病药物总共9个,覆盖超过10种罕见病,已经完成和正在进行的临床实验超过50项。”
但除了研发,罕见病药物的准入、上市后如何提高可及性也是难题。
张巍峰表示,“当临床实验的结果交到国家药品监督管理局的时候,由于这些数据相对比较贫乏,不像糖尿病、高血压有几万人的数据,罕见病一般只有几十人的数据。要做出一个有效的、正确的判断,本身也是一个很困难的过程。”
在美国,“很多小型生物制药公司在罕见疾病药物的研发前期阶段,会得到非常多的公共资源支持。”黄如方介绍,如果没有政策优惠,研发难以为继,美国最大的亨廷顿舞蹈症基金会每年投入数千万美元进行科研,“很多钱都是打水漂的,亨廷顿舞蹈症现在仍然没有治疗药物,基础研究一定需要公共资源去投入。罕见病的产品到临床阶段才可能挣钱。欧美很多小的孤儿药公司当药物到临床阶段就卖给大公司。中国现在非常薄弱的环节是公共资源的投入非常少,到底能募集到多少公共资源去投入到药物前期研发阶段,我们自己也在思考这个问题。”
另外,也会出现一些“中国特色的问题”,比如一些药物进入国内后没有相应的罕见病适应症获批;进了医保但在医院买不到药,黄如方说,“都是因为中国医疗体制和政策的问题,比如对于药占比的过度考核导致很多罕见病药物在一些医院买不到;一些疾病需要门诊治疗,但是政策规定可能住院治疗才能报销。”
在罕见病救助和保障方面,我国各地方政府也正在因地制宜地摸索出各种特色模式。罕见病发展中心(CORD)高级顾问、青岛市社会保险研究会副会长刘军帅介绍,在罕见病领域,我国已有很多地方探索出很多模式,比如浙江模式、青岛模式,这些模式都是由当地政府主导,部分病种多方共付的模式。具有政府多部门联动、社会多方资源共享的特点,这样患者在报销后,自己支付的费用在承受范围内,最大程度减轻患者经济负担。
“医疗保障制度最关键在于公平和可持续。”刘军帅认为,一方面可以将社会保险与慈善相结合,提高罕见病药报销比例;另一方面,针对罕见病医保报销制定出独立的罕见病政策,单独筹资单独支付。医保三大要素,筹资、待遇、付费,三者均需独立。“罕见病医疗保障是一个伦理问题,少数人的生命也是生命,所以必须给予良好的福利政策;但是,如果与其他病放在同一个体系里,公平性问题必然绕不开,所以需要独立筹资独立运作。”