本期编辑:王晶晶
本期校对:霍力 余卫 段炼
前情提要
44岁男性,骨痛18年,身高变矮18cm。2005年在我院明确诊断肿瘤相关性低磷骨软化症,手术切除肿瘤后症状缓解长达十年。2015年起相同的症状卷土重来,是肿瘤原位复发还是新生病灶?患者的生活能否再次回归平静?请看协和罕见病多科会诊如何通过多学科交互为病人寻找诊疗的下一步方向。
患者病史
第一次入院(2005.02~05)

奥曲肽显像
临床症状:2001年起逐渐出现多发骨痛、乏力、活动受限、身高变矮、骨骼畸形
检验:P 0.32mmol/l,ALP 272U/L,Ca、PTH正常
影像学:
X线检查:骨密度减低,多发椎体压缩性骨折、肋骨骨折
奥曲肽显像:左膝关节上方外侧有一生长抑素受体高表达病变
BUS、CT和MRI:左膝关节上方外侧囊实性肿物
治疗:
后于协和医院骨科行左股骨下端肿物切除+骨水泥填充术。
术后病理示:恶性尿磷性间叶组织肿瘤。免疫组化:Ki-67 约30%(+),HMB45(-),SMA部分(+);特染AB、PAS(间质及血管周(+))。瘤组织破坏骨皮质,累及周边横纹肌。
l 术后给予放疗(DT50Gy/25f/5w)。
l 术后血磷恢复正常,予钙剂和活性维生素D治疗,症状明显改善。
其后近10年间未复诊,病情稳定。
第二次入院(2015.07~08)

a.骨显像 b. 奥曲肽显像 c. GaDOTATATE-PET/CT d. MRI e. CT
临床症状:2015年再发双足跟伴膝关节疼痛
检验:P 0.34mmol/l,ALP 161U/L,24hUP 20.25mmol,Ca、PTH正常
影像学:
骨显像:左侧股骨下段术后改变可能;右侧胫骨上端、双侧髋臼、双侧踝关节骨折不除外。
奥曲肽显像:右侧胫骨内侧髁局部生长抑素受体高表达;左侧股骨远端外侧软组织生长抑素受体表达不均匀稍增高。
68GaDOTATATE-PET/CT:右胫骨上端内侧髁放射性浓聚。
膝关节MRI:左侧股骨下段异常低信号;右侧胫骨上端内侧骨折伴脊髓水肿。
双下肢+胫腓骨CT:左侧股骨下段后部术后改变;右侧胫骨内侧髁、胫骨上段多发低密度影;双侧股骨远端,胫腓骨近段和远端多发低密度影。
骨科、核医学科及放射科教授讨论:
CT未见可疑病灶,考虑生长抑素受体显像及PET/CT可疑病灶可能为骨折后成骨反应。
治疗:
予中性磷,活性维生素D治疗后症状明显好转。
第三次入院(2017.07~08)

奥曲肽显像
临床症状:2016-05起再次出现关节疼痛,2017-07收入我院
检验:P 0.43mmol/L, ALP 179U/L, 24hUP 15.87mmol,Ca、PTH正常
影像学:
骨扫描:双侧踝关节病变大致同前,右膝关节加重,右侧胫骨上端骨折及假性骨折,左胫骨中段术后修复改变。
奥曲肽显像:相当于双侧大腿下段、左小腿上段生长抑素受体表达增高。断层显像:未见明确TIO病灶;双侧股骨远端及右侧胫骨近端局部生长抑素受体稍高表达病灶,炎性病变或假性骨折可能。
双大腿MRI:左侧股骨下段术后改变;右侧股骨内侧髁及双侧胫骨近端异常信号影。
双下肢CT + 三维重建:左侧股骨下段肿物切除术后改变,大致同前;双侧股骨头密度欠均,双侧髋臼可见多发类圆形低密度影,较前显示清晰;双侧股骨内侧髁、胫骨上段多发低密度影,较前显示清晰。
治疗:
予中性磷,活性维生素D治疗。
本次入院

a. 奥曲肽显像 b. GaDOTATATE-PET/CT
临床症状:2017年出院后身高变矮5cm,牙齿脱落1颗
检验:P 0.48mmol/L,ALP 242U/L,Ca、PTH正常
影像学:
奥曲肽显像:未见明确生长抑素受体高表达灶
镓标PET/CT:未见明确TIO病灶,右侧股骨上端、双侧膝关节、右侧距骨及左跟骨见代谢略增高,SUVmax2.0,考虑炎性病变可能;左股骨下端术后改变。
膝关节常规MRI:左侧胫骨近段骨折伴骨髓水肿;原右侧胫骨上端内侧骨折伴骨髓水肿,较前好转。
治疗:
予中性磷,活性维生素D治疗。
其他情况
既往史、家族史:无特殊。
个人史:吸烟饮酒17年。
查体:步态摇摆。牙齿松动明显。胸廓前凸,胸骨压痛(+),胸廓挤压痛(+),肋髂距2指。脊柱侧弯,后凸畸形,脊柱压痛、叩击痛(+)。
初步诊断
肿瘤相关性低磷骨软化症
恶性尿磷性间叶组织肿瘤复发可能性大
左下肢恶性尿磷性间叶组织肿瘤切除+骨水泥填充术后+放射治疗
多发肋骨、胸腰椎骨折史
旨在为患者寻找病因,明确肿瘤病灶。
参与多学科讨论的科室
心内科 内分泌科 放射科 核医学科
放疗科 儿科 病理科 骨科 肾内科
中日医院神经科 临床遗传实验室
专家名单
(排名不分先后)
陈丽萌 陈未 段炼 高鹏 顾卫红
霍力 黄尚志 金今 余卫 林雪 李伟
刘永太 邱正庆 宋红梅 王海
吴焕文 吴炜 吴志宏 夏维波
张福泉 张抒扬 朱文玲 张为民 朱燕林
与会工作人员和护士
马玉芬 刘彤 任文胜 顾媛 秦薇 赵琳 李相言
石静琳 陈敬丹 姜秀春 秦伟
其他与会人员
多名在读医学生 研究生及进修医师参会学习
致谢
感谢北京协和医院各位专家、院外专家以及北京协和医院疑难病会诊中心对MDT的大力支持
MDT讨论与诊疗
1.尿磷性间叶组织肿瘤的手术治疗和放疗
手术治疗是该类肿瘤的主要治疗方式。该类肿瘤多为良性,但是该患者术中发现肿瘤侵润骨皮质和横纹肌,考虑恶性病变而采取扩大切除、辅助石炭酸冲洗及电烧处理,并辅以术后放疗。
放疗方面:该类肿瘤多为良性和低度恶性,临床上很少进行放疗。但是对于恶性程度高的间叶组织肿瘤,术后放疗是很有必要的。同时,间叶性肿瘤对放疗不太敏感,如果对于间叶组织肿瘤进行放疗,需要提高放疗剂量。由于该患者肿瘤位于膝关节,考虑到放疗剂量过大会影响膝关节功能,所以当时的放疗剂量较保守,可能是此次复发的一个原因。
2.尿磷性间叶组织肿瘤的复发情况?是否存在可以预测复发的指标?
目前没有预测尿磷性间叶组织肿瘤复发的明确指标。我院病理科总结了200多例尿磷性间叶组织肿瘤,20多人术后复发。复发大致可分为两种情况:1.术后血磷未恢复正常:肿瘤未切除干净,复发间隔短。2.术后血磷恢复正常:肿瘤切除干净,复发间隔长。所有病例都是原位复发,即使出现了远处转移的病灶,也是从原位复发的病灶转移而来。所以该例病人可能存在原位、隐匿、微小的复发病灶。我院各科室诊断的TIO病人共300余例,总结我院复发的病例的特点来看:血磷水平极低、肿瘤来源骨骼(尤其是脊柱)、Ki-67高的病人较为多见恶性。近期我院诊断TIO术后病人因肺部转移去世,远处转移可见于肺部。故建议该患者完善肺部CT。部分转移的青年病人可见牙槽骨转移病灶,但该患者此次骨显像、奥曲肽显像及镓标PET/CT检查口腔及全身其余部位未见转移灶。
3.核医学科检查对于诊断尿磷性间叶组织肿瘤的价值
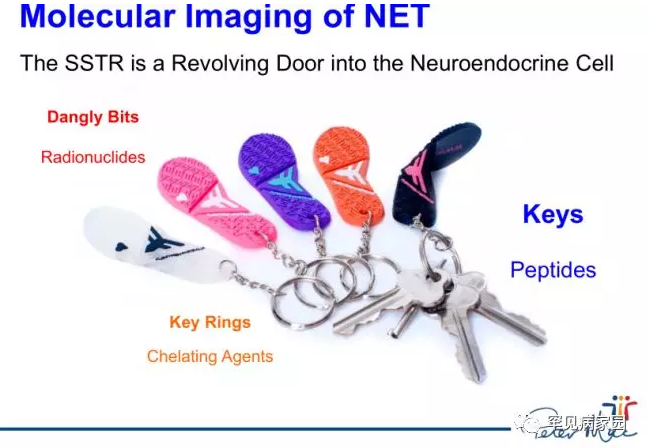
(1)核医学生长抑素受体显像诊断TIO原理
TIO病灶多表达生长抑素受体2(SSTR2),核素标记的生长抑素(奥曲肽)类似物与受体结合使核素定位于病灶,通过SPECT(99m锝-HTOC)或者PET显像(68镓-DOTA-TATE)探测核素浓聚的部位可以准确的定位TIO致病肿瘤所在之处。一般TIO病灶在生长抑素受体显像检查中对显像剂浓聚明显高于骨组织及周围组织,形状呈类圆形,同时常伴有骨或者软组织的密度改变,患者2005年术前我院门诊生长抑素受体显像即因呈现上述异常影像特点而被准确而特异的检测出TIO病灶。2005-3月术后复查生长抑素受体显像显示肿瘤病灶完全清除,未见明显浓聚,对侧大腿可见片状病灶,为肌肉的非特异性摄取。

TIO患者因骨钙磷代谢长期异常易合并衰竭性骨折(insufficient fracture,IF),多处骨折,骨折修复在生长抑素受体显像上也可表现为摄取增高病灶,但摄取程度要明显低于肿瘤病灶,且形态多表现为片状、条状及线状,很少呈现结节状浓聚,CT上表现为絮片状密度增高区,骨质破坏不严重。
(2)核医学骨显像方法在TIO中的应用
骨显像的显像剂是MDP,可以反映局部骨血供及钙盐代谢情况,骨质疏松、骨折及局部复发病灶均可见高浓聚表现,若手术区域附近出现高浓聚不能判断术后修复还是复发病灶,这种情况下需生长抑素受体显像检查来验证。
该患者2015年病情复发后我院查骨显像提示术区可见局部骨代谢异常,进一步完善生长抑素受体显像该处无明显异常浓聚,故考虑为非特异性修复。
(3)核医学FDG PET/CT检查方法在TIO中的应用
FDG PET/CT显像的显像剂是葡萄糖类似物,可以被大多数异常增殖、葡萄糖代谢异常增高的恶性肿瘤所摄取,一般TIO病灶都是良性的,肿瘤本身增殖活性不高,因此在FDG PET/CT上的代谢活性与周围正常组织是相似的,表现为阴性。但由于这个患者Ki67指数较高(30%),有恶性倾向,因此该患者在外院行FDG PET/CT检查意图发现局部复发或者转移病灶,但检查未见明显异常浓聚病灶,因此不考虑局部复发以及转移可能。
综上所述,该患者此次住院前后进行的所有核医学检查(外院FDG PET/CT、我院生长抑素受体显像(99m锝-HTOC以及68镓-DOTA-TATE PET/CT)和骨显像),均未能发现局部复发及转移病灶。生长抑素受体显像所提示的对侧膝关节及踝关节内侧较上次检查相比摄取略有增高,完善这个部位CT、MRI检查未见明显异常病灶,考虑为术后对侧肢体撑重、劳损后的非特性摄取,特别是右侧膝关节片状摄取增高,断层提示骨皮质增厚,更支持术后膝关节修复表现,骨显像支持骨质疏松及多发骨折表现。
(4)结合可鉴别骨质修复和病灶。
4. 放射科教授自阅片
患者2017年左膝关节正侧位片与此次左膝关节CT检查相比左膝关节内侧、术区附近可见新发局部膨胀病灶,不除外转移病灶。

5.若无法明确病灶,下一步如何处理?
找不到病灶的情况下可给予中性磷及活性维生素D治疗可改善症状,若上述治疗无效,FGF-23抗体治疗可能近期开展临床试验,可参与治疗观察疗效。能否取血FGF-23测定检查来明确患者定位诊断需要进一步联系介入科。
会诊意见
1.完善胸部CT明确有无远处转移。
2.对放射科教授考虑可疑病灶的部位完善双膝关节正侧位,若仍提示与上次住院检查结果比较有变化,可考虑局部穿刺活检明确病灶性质,穿刺活检包括透视下穿刺活检、由骨科医师进行操作,另外一种穿刺方法是介入科医师在CT引导下穿刺活检,比较其两种方式、CT引导下取活检术成功率可能更高,联系介入科医师讨论穿刺活检的可行性及相关风险,酌情决定穿刺活检方式。(已与介入科大夫讨论过,目前可疑病变穿刺活检创伤较大,暂不做穿刺)
3.参阅国外FGF 23全身及局部取血检查在类似病例当中的操作方式、明确诊断的价值,与介入科医师讨论能否行有创性检查协助明确病灶。
4.骨科教授表示:若放射科怀疑病灶可明确定位,需要进一步手术,治疗方式选择股骨远端及胫骨近端截骨并关节置换术,手术风险及创伤、费用均较高。
5.若此次检查仍不能明确定位,建议药物保守治疗,定期复查继续寻找病灶,继续目前药物治疗,待国内开展FGF23抗体治疗的临床试验时可参与相关药物临床研究。
文献与知识点回顾
1.肿瘤相关性骨软化症(Tumour-induced osteomalacia,TIO )
1947年Mccance描述了首例TIO, 1959年Prader率先提出肿瘤可引起骨软化,又称肿瘤性骨软化,是一种罕见的副肿瘤综合征。TIO更多表现在成人,平均诊断年龄为40-45岁,但这种综合征可出现于任何年龄,最小患病者仅9月大。主要临床特征为进行性加重的骨痛、乏力,严重者可有骨折、骨骼畸形、活动障碍等。骨痛是最常见的症状,往往首先出现于下肢。病理性骨折最常见于椎骨、肋骨、股骨和骨盆,是TIO致残、致死主要原因。典型的生化特点:血清磷降低、尿液中磷酸盐排泄增加,在低磷血症时本应升高1,25(OH)2D3水平降低或维持在不恰当的正常水平,ALP升高,钙和PTH 通常不受影响。
机制:肿瘤分泌FGF-23,导致尿磷重吸收↓,活性D↓→肠磷吸收↓
诊断:肿瘤体积小,可分布于全身各处,定位困难
病理:磷酸盐尿性间叶肿瘤(PMT)
治疗:首选手术
大多数TIO患者循环FGF-23水平显著升高,手术切除肿瘤后迅速下降
2.疾 病 误 诊
延迟诊断:从起病到正确诊断平均需2.9±2.3年,到肿瘤切除平均需5.4±4.2年
误诊率高:95.1% (137/144)被误诊,240次误诊,最常被误诊为椎间盘突出、强直性脊柱炎、骨质疏松。

3.定 位 诊 断
TIO表达多种生长抑素受体SSTR1、2A、2B、3、4、5
奥曲肽显像:敏感性86.3%,特异性99.1%;复发患者:敏感性86.7%
68 Ga-DOTATATE-PET/CT:敏感性100%,特异性90.9%。且其空间分辨率较奥曲肽显像高。
4.TIO 病 灶 分 布

参考文献
1.Nature Reviews Disease Primers volume3, Article number: 17044 (2017)
2. Endocr J. 2017 Jul 28;64(7):675-683.
3.Clin Nucl Med 2015;40: 642–646
4. Eur J Radiol. 2013 Nov;82(11):2028-34.
5. Clin Nucl Med. 2019 Mar;44(3):209-213.
6.冯娟 学位论文 《肿瘤性骨软化症的临床及骨微结构特征研究》