根据患者意愿和医生需求,提供最先进诊疗方法二次建议咨询,目的是以患者为核心,有更多选择和了解最适合自己疾病治疗方法。
美国FDA批准了针对罕见的内分泌恶性肿瘤:嗜铬细胞瘤和副神经节瘤(PPGL),特别是晚期患者所采用的放射性核素治疗方法。该方法主要针对医疗专业人员,患者和家属可以在主诊医生那里获得相关咨询建议。
嗜铬细胞瘤是肾上腺的神经内分泌肿瘤
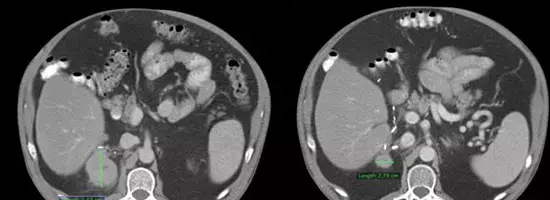
用高特异性I-131MIBG治疗12个月后,患者肿瘤明显缩小(右)
神经节旁瘤是指在自主神经系统神经节旁出现的肿瘤。如果肿瘤源于肾上腺髓质,则称为嗜铬细胞瘤。
这些内分泌肿瘤统称PPGL(Pheochromocytomas and paragangliomas, PPGL)。临床上内分泌肿瘤包括所有内分泌系统相关肿瘤,不分组织和器官部位。
由于临床上PPGL患者很少见或罕见,FDA批准了首个,也是唯一一种用于治疗12岁及以上晚期PPGL药物。这些患者对去甲肾上腺素转运蛋白呈阳性(碘苯胍扫描确定),需要全身性抗癌治疗。目前,该治疗方法尚未在美国以外获得授权批准应用于临床治疗。
诊断PPGL并非易事
据统计,PPGL每百万人群中不超过8例新确诊患者。由于该疾病少见和临床症状非特异性,患者肿瘤很难诊断或鉴别。很多情形下,耽误了确诊和有效治疗方法选择。
例如,有些PPGL患者被误诊为癫痫;还有些患者由于分泌大量儿茶酚胺,以及其他内分泌激素过多相关症状(最常见高血压),主诊医生误诊为其中严重的并发症,而不是原发疾病诊断。
有些患者表现出汗多、心慌等;还有些人被认为患有先天性高血压,甚至心力衰竭或卒中。
诊断和鉴别诊断
确诊分泌型PPGL主要依靠相关生化检查,包括检查儿茶酚胺(间肾上腺素)及其分解产物;然后影像学检查是否有实体性肿瘤存在。
据权威专家点评,如果患者血液中肾上腺素正常,则不太可能是分泌型PPGL。但并不排除非分泌性肿瘤,比如肿瘤可能出现在颈部,则有局部症状表现(甲状腺瘤)。
对PPGL患者的遗传学检查有助于鉴别诊断。根据目前临床案例统计报告,多达50%患者可能与几种基因之一的突变相关。
如果怀疑有家族史倾向,基因检测可以发现更多潜在家人患有PPGL高危险。有必要深入探讨有效和精准的筛查和监测方案。
有限的治疗方法
已知仅有10—25%PPGL患者出现转移扩散,但无精准方式预测可能转移部位。因此不应轻言为良性肿瘤。早期诊断PPGL患者的治疗方法包括:手术、监视或外照射治疗等。
在安全且有手术适应症前提下,手术目标是对原发肿瘤进行切除,特别是具有分泌性或远处转移性,以及高风险突变基因相关的遗传性PPGL病例。
多年来,针对转移性或晚期患者必须进行全身治疗,包括采用一些姑息性化疗药物和放射性治疗药物,比如说,全身性治疗,间碘苄基胍(MIBG,碘苯胍),它是去甲肾上腺素再摄取转运蛋白(NET)底物。通常在PPGL癌细胞表面上过表达。
上世纪80年代后,MIBG被广泛采用放射标记形式(通常碘131标记),用于治疗神经内分泌肿瘤。I-131 MIBG结合至其靶标并被内化后,利用辐射作用损伤DNA,最终导致癌细胞死亡。
目前I-131 MIBG治疗方法
根据宾大医学院核医学与临床分子影像学主任Daniel Pryma评述,最初I-131MIBG制备过程效率低下,超过99%分子没有放射性碘标记,导致产品比活度非常低(〜16 mCi /mg)。未标记的MIBG分子出现竞争NET结合位点,并破坏去甲肾上腺素再摄取机制,导致了过量儿茶酚胺溢入循环系统。
这样以来,不仅疗效差,还导致急性儿茶酚胺诱发的心血管系统继发症状。因此,不建议采用原来/现有工艺制备的放疗疗法(I-131MIBG)。
FDA批准新工艺制备的高效PPGL
FDA批准的最新制备工艺方法能产生I-131 MIBG高特异性活性(〜2500居里/毫克),几乎所有分子都标有同位素,避免竞争结合NET点的风险,降低了循环儿茶酚胺诱发不良副作用和潜在风险。
FDA认为最新工艺制备I-131 MIBG对主要临床症状有明确意义,包括控制肿瘤大小,减少或降低儿茶酚胺癌细胞及分泌。这意味控制高血压症状,减少或不必再服用抗高血压药。
成功案例
在68位确诊PPGL晚期患者中,采用高特异性I-131 MIBG治疗,其中有17名(25%)减少或不再服用高血压药物(6个月以上);接受了两次治疗剂量的患者,98%的肿瘤大小缩小或稳定。
常见不良反应包括恶心、骨髓抑制(骨髓活性降低)和疲劳。长期随访患者,有44%患者存活已经超过四年。
FDA认为对于晚期PPGL患者,高特异性活性I-131 MIBG治疗能够让患者多重获益,包括控制肿瘤生长、稳定血压以及延长寿命。