杜氏肌营养不良(Duchenne Muscular Dystrophy,DMD)是一种由于位于X染色体上基因突变造成的隐性遗传性疾病。以肌肉无力和萎缩为主要特征,是极具致死性的儿童罕见病之一。其症状多发于男性,而女性常为突变基因携带者。据估计,全世界范围内,每3500个男婴中便有一个DMD患者,其中70%的人其母亲是该突变基因携带者,其余由胚胎自身基因突变造成。如果母亲是该突变基因携带者,其所生儿子则有一半概率成为DMD患儿,而女儿则有一半几率是该基因携带者。

在欧洲和北美,DMD的患病率大约为1/100,000。在中国这一数字还未得到确定,但由于人口基数大并且医疗水平限制,估计会明显高于这一统计数字。由于DMD的隐形遗传性并且在患病初期几乎没有临床症状,因而对有DMD家庭病史的孕期妇女进行基因早筛尤为必要,在发达国家中,早期基因诊断准确率高达95%。根据美国食品药品监督管理局(Food and Drug Administration,FDA)的定义,罕见病又称孤儿病(Orphan Disease )是指世界范围内不超过200,000 病例的情况,由于对其研究匮乏加上疾病后果严重,长期面临着确诊难、治疗难、买药难的困境, 也是是公共健康领域亟待解决的难题。
DMD 疾病的发现、病理学特征和产生机制
法国神经学家Duchenne De Boulogne在20世纪80年代初首次精确的描述了DMD的症状。他发明了一个可随身携带的电装置并用其将人体各部位肌肉与其功能相对应起来进行研究. 在此之前,人们对任何肌肉有关的疾病都知之甚少。由于Duchenne De Boulogne在感应电学说和肌肉疾病领域的贡献,受到人们尊敬,并用其姓氏命名了该疾病。
1987年,研究人员进一步发现位于X染色体短臂的Xp21.2位点上的抗肌萎缩基因编码的蛋白(Dystrophi)缺失会使得肌肉细胞变得脆弱并受到损伤。抗肌萎缩基因是反向遗传学发现的第一批基因之一,也是目前已知的人类30,000个编码蛋白的基因组中最大的基因,其长度覆盖了2.2Mb,约占人类基因组的0.1%。包括了79个外显子和78个内含子,并带有11.5kb 的开放阅读框。这使得该基因在传代的过程中及易重新排列和组合从而导致变异。大多数情况下(60%)的 变异是由于一个或者多个外显子的缺失造成,而少数情况(6%)是由于基因复制或者异位。然而,无论什么原因的基因突变最终都会导致抗肌萎缩蛋白的转录和翻译异常,使抗肌萎缩蛋白的合成在早期终止。抗肌萎缩蛋白主要分布于肌肉组织和心脏组织的细胞中,少量也存在神经细胞中。细而长的肌细胞(又称肌纤维)膜上含丰富的蛋白,这些蛋白相互作用来维持肌纤维张力以及使得肌肉组织在收缩和被拉长中不收损伤。附着在心肌质膜(Sarcolemma)的抗肌萎缩蛋白就是其中之一,其在肌细胞骨架与细胞外基质的连接起着支持固定作用。同时,该蛋白还可能在化学信号的传导中起着重要作用。抗肌萎缩蛋白合成受损会带来肌纤维受损以及细胞膜破裂,最终导致以肌肉无力和萎缩为主要特征的DMD症候群。

虽然是遗传性疾病,DMD最早于2岁才会产生临床症状,首发于身体靠近肢体部位的前端肌肉,逐步扩散至远端的四肢。并且下肢比上肢更早受到影响。患儿因此逐渐丧失跑跳和行走的能力。此外,鸭步、小腿肿大以及腰椎前弯也是其常见特征。大部分患者到12岁时只能靠轮椅行动。此外,由于DMD主要影响心肌和骨骼肌细胞,使得DMD患者心肺功能遭到严重影响。长期的肌肉无力和脊柱侧弯使得肺功能受损,20岁开始便需要辅助呼吸,在20多岁到40岁之间死于心脏或者呼吸衰竭。
DMD基因治疗的挑战
尽管DMD 的疾病体征以及分子遗传学起因在上世纪80年代就被发现,目前的临床治疗尚不能根治,主要用激素类的类固醇药物缓解其临床症状从而减缓其疾病进程。研究表明细胞的免疫反应可能会产生细胞因子从而加速疾病的病理进程,类固醇类药物由于可以抑制肌细胞的免疫反应,在长期肌肉受损的病人使用很常见。由于疾病的护理手段的改善,病人的寿命可以被延长至四十多岁。然而,从根本上治疗疾病的仍然是亟待解决的问题。由于抗肌萎缩蛋白基因及其编码蛋白是DMD发病的根源,能够修正错误基因的基因疗法是目前研究的热点。然而,虽然很多疗法在动物模型中被证实有效,真正在临床应用还需要克服很多困难。
传统的基因治疗法对抗DMD最大的难点在于抗肌萎缩蛋白的基因片段过于庞大。为了将一个14kb 分子量427 kDa的抗肌萎缩蛋白cDNA大分子插入到肌细胞细胞核中,基因载体容量必须足够大并且不产生宿主细胞免疫反应。而第一代腺病毒载体只能运送最多大小为8kb的cDNA。
重组型腺相关病毒(Recombinant Adeno-Associated Viral,rAAV) 是已知的最小Parvoviridae病毒家族成员,是目前常用的基因治疗载体之一。具有不致病性、广泛宿主范围、强组织定向性(Broad Tropism)、低免疫反应以及能够实现的强大和持久的转基因表达等种种特点,已经在超过20多个临床实验中被运用。由于rAAV显示了对肌肉组织的定向性,使其在基因治疗DMD应用中极具潜力。各种血清型rAAV(1,5,6,7)已经在小鼠实验中被证明对肌肉组织很好的定向性和高转染率。值得一提的是,rAAV系统尤其对心肌细胞具有很高的转染率(>50%),并且在动物实验中被证明该效果能持续2个月之久。由于超过90%的DMD患者都会伴随心肌病, rAAV受到到格外的研究关注。然而,rAAV载体系统最大的弊端是是其小载体容量(~5kb)。因此对其进行工程化是目前研究新方向。后来出现的无病毒载体(Gutless Vector)虽然能够满足大容量载体的要求并且由于缺失了全部或大部分腺病毒基因而减少了宿主细胞的免疫反应性以及加强了对肌细胞的转染率,由于它们很难穿透成熟肌细胞外基质并且肌细胞缺少相应的膜受体,将其用于临床治疗还为时尚早。
I型单纯疱疹病毒型载体(Herpes Simplex Viral Vectors)虽然能够在人体内协助插入大分子基因片段并且导入率很高,其效率只在新生儿和具有再生能力的肌肉组织中被证明。另一方面,其免疫原性和对细胞的毒性作用也限制了被转换基因的长期表达。而经过工程化的非病毒类的DNA质粒载体虽然也能够高效的将大分子目的基因片段插入细胞中并且不产生毒性作用,这类载体被证明在肌肉组织中的效率不高,因而必须借助其他方式以加强转染率,例如电穿孔,肢体隔离加压灌注以及超声波等。
成肌细胞移植(Myoblast Transplantation) 是另一类基因治疗DMD的潜在方式。该方法目的将正常表达的野生型抗肌萎缩蛋白的基因心肌细胞通过肌肉注射移植到病人体内,使得患病小鼠的缺陷肌细胞能够与外源性正常心机细胞相嫁接从而表达正常抗肌萎缩蛋白。目前该方法已经在小鼠模型中被成功证明能够明显增加患病小鼠的肌肉张力。然而如同其他方法一样,该方法用于临床实验最大的障碍是外源性心肌细胞的来源以及宿主细胞的免疫原性。除此之外,外源性心肌细胞在移植后的低存活率和分化率也是需要面对的问题。
新型DMD基因治疗方式
1.反义寡核苷酸介导的外显子跳跃法(Antisense Oligonucleotide-Induced Exon Skipping)
反义寡核苷酸(Antisense Oligonucleotide, AON)介导的外显子跳跃疗法是将反义寡核苷酸结合到mRNA前体上的互补序列,旨在通过对抗肌萎缩蛋白mRNA前体的剪接过程的调节达到有效的目标外显子跳跃从而恢复DMD基因的转录阅读框,产生一种长度虽然缩短但仍具部分功能的抗肌萎缩蛋白。利用该原理研发的一些新药已经在临床试验中被证实可恢复DMD患者抗肌萎缩蛋白基因表达功能。例如基于外显子51跳跃法的两款AON药物Drisapersen 以及Eteplirsen。然而Drisapersen由于在III期临床实验中获得失败,被美国食品药品监督管理局(US Food and Drug Administration,FDA)在2016年1月拒绝上市。Eteplirsen 适用于14%的DMD患者的基因突变,并于2016年9月被FDA授予快速通过,成为首个治疗DMD的孤儿药。近日,一家来日本的新药株式会社(Nippon Shinyaku)通过引入外显子53跳跃开发了另一个DMD靶向药物Viltolarsen(NS-065/NCNP-01)。该公司近日宣布已经在日本的I,II期临床试验中证实可恢复DMD患者抗肌萎缩蛋白基因表达功能并于近日向FDA提交了新药申请。

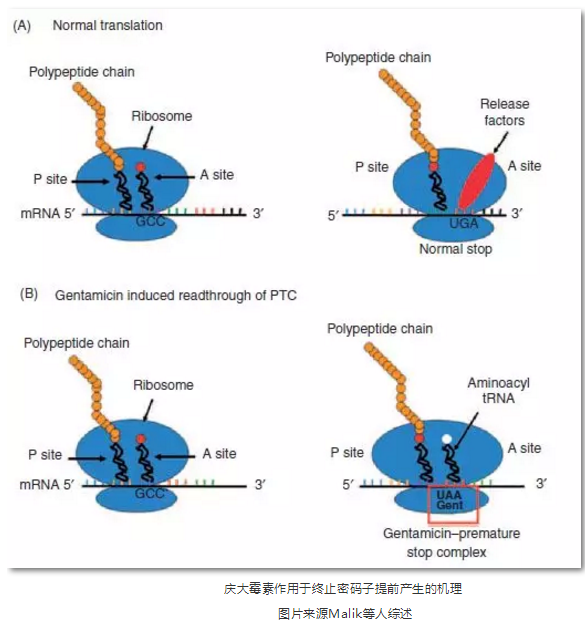
2.氨基糖苷类介导的终止密码子通读 (Aminoglycoside-Induced Stop Codon Readthrough)
氨基糖苷药物是一类抗菌素,起先主要用于治疗革兰氏阴性菌引起的感染。早在20世纪60年代,研究人员发现一些氨基糖苷药物可以通过抑制核糖体校对达到降低基因翻译忠实度的效果。后来的基因学和生化研究进一步证实,这些抗生素可以在任何真核和原核生物中与核糖体RNA (rRNA)解码区域相结合导致其结构变化,使得在蛋白翻译过程中的密码子和反密码子的配对受挫。氨基糖苷药物可以在转运RNA接受位点终止密码区插入一个氨基酸从而破坏关联和非关联区域的解读。利用这一原理治疗DMD可以通过忽略终止密码子提前产生而避免无义突变(Nonsense Mutation)产生包含抗肌萎缩蛋白全长的蛋白。适用于由该原因导致的15%的DMD病人。目前,常规抗生素庆大霉素在一些DMD患者疗效研究已经开始,但唯一可查的调查报告显示结果并不理想。对mdx小鼠进行庆大霉素治疗后其抗肌萎缩蛋白的表达轻微增加,然而在后续实验中这个效果并没有出现。而且人体试验中这一蛋白表达的增幅很小,并且长期使用这类药物会有肾毒性和耳毒性。因而对氨基糖苷类介导的终止密码子通读在DMD中的应用还需深入研究。
文章来源
[1] Novartis positive 52-week PREVENT data confirm Cosentyx® efficacy in addressing entire axSpA spectrum. Retrieved October 19,2019 from https://www.globenewswire.com/news-release/2019/10/02/1923802/0/en/Novartis-positive-52-week-PREVENT-data-confirm-Cosentyx-efficacy-in-addressing-entire-axSpA-spectrum.html
[2]Duchenne Muscular Dystrophy (DMD). Retrieved October 19,2019 from https://www.mda.org/disease/duchenne-muscular-dystrophy
[3] Rare Disease Database. Retrieved October 19,2019 from https://rarediseases.org/rare-diseases/duchenne-muscular-dystrophy/
[4] DMD gene. Retrieved October 19,2019 from https://ghr.nlm.nih.gov/gene/DMD
[5] van Deutekom, J.C. and G.J. van Ommen, Advances in Duchenne muscular dystrophy gene therapy. Nat Rev Genet, 2003. 4(10): p. 774-83.
[6] Malik, V., et al., Aminoglycoside-induced mutation suppression (stop codon readthrough) as a therapeutic strategy for Duchenne muscular dystrophy. Ther Adv Neurol Disord, 2010. 3(6): p. 379-89.
[7] Athanasopoulos, T., et al., Recombinant adeno-associated viral (rAAV) vectors as therapeutic tools for Duchenne muscular dystrophy (DMD). Gene Ther, 2004. 11 Suppl 1: p. S109-21.
[8] Watanabe, N., et al., NS-065/NCNP-01: An Antisense Oligonucleotide for Potential Treatment of Exon 53 Skipping in Duchenne Muscular Dystrophy. Mol Ther Nucleic Acids, 2018. 13: p. 442-449.