在11月12日的文章中,目前正在进行SUNFISH试验的国内医疗机构中,不慎遗漏了复旦大学儿科医院(Children's Hospital of Fudan University)。特此致歉!
健点子ihealth向辛勤工作,为这个新药的早日审批上市的医疗专家,工作者和研发人员表示深深敬意!
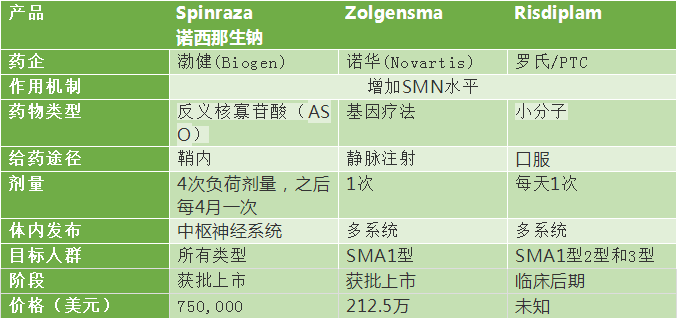
罗氏的口服用药risdiplam(RO7034067)最新公布的结果显示,将可能成为继渤健的小核酸诺西那生钠,诺华的基因治疗Zolgensma之后,又一个针对脊髓肌萎缩(SMA)的新药。
脊髓肌萎缩是一种遗传性神经肌肉疾病,表现为脊髓运动神经元的进行性退化和丧失,导致了肌无力和肌萎缩。
脊髓肌萎缩根据发病年龄和严重程度共分为4型,其中,1型最为严重,主要发生于6个月内的婴儿,表现为关节挛缩,呼吸功能弱,通常只有两岁的生命。
相比之下,2型和3型的脊髓肌萎缩发病较晚,症状较轻,可以独坐。70%的2型SMA患者可以活到25岁,而3型SMA患者寿命正常。
瑞士药企罗氏公司公布了最新的太阳鱼SUNFISH试验结果,这个试验评估Risdiplam治疗2-25岁的患有脊髓肌萎缩(SMA)II型和III型的患者。
Risdiplam是一种神经运动元(SMN2)的剪接调节因子,旨在纠正SMN2功能。这个新药的工作原理是促进从SMN2“备份”基因(“backup” gene)产生神经运动元SMN。
资料显示,罗氏和PTC公司联合开发,并得到了患者组织SMA基金会(SMA Foundation)的支持。
这个最新的结果显示,与安慰剂相比,在服用Risdiplam(RO7034067)一年后,达到了运动功能测量32(MFM-32)尺度基线变化的主要终点。
而且,在安全性方面,任何risdiplam试验中,都未发现任何导致研究撤回的治疗相关事件。安全与其已知的安全状况一致,没有发现新的安全信号。
罗氏表示,这个结果是一个重要的里程碑,因为,很多脊髓肌萎缩2型和3型的患者没有得到及时的治疗。
"对于2型或3型SMA患者来说,这次试验的积极结果具有一个重要的里程碑,其中太多人仍未得到治疗。"罗氏首席医疗官兼全球产品开发主管Levi Garraway博士表示说。
SUNFISH 试验也是针对 2 型/3 型 SMA 患者迄今为止规模最大安慰剂对照研究,他补充表示。
SUNFISH的试验计划招募50名患者,跨越欧洲和美国加拿大。
在国内,罗氏已经早在2017年年底就申请了口服溶液用粉末RO7034067的临床试验。据药智的数据显示,目前针对1型,2型和3型的二期临床试验正在进行中,招募患者完毕,试验机构为北京大学第一医院和复旦大学儿科医院。

罗氏高管对SMA患者社区的合作表示感谢,并期待与监管机构分享这些结果,尽快将这个新药带给更多的SMA患者。
目前,SMA是最常见的导致婴儿死亡的遗传性神经肌肉疾病,也是罕见病。据估计11000婴儿中就有1人患有SMA。
目前有三个针对SMA的新药,其中两个已经获批,罗氏的口服新药正在上路。
在研和获批的SMA治疗新药比较: