根据一个阶段的数据,Pharnext的口服实验治疗PXT3003 被发现对患有Charcot-Marie-Tooth 1A型(CMT1A)的患者是安全有效的,可以改善临床结果并在两年的治疗过程中稳定疾病的进展3试验及其开放标签扩展研究。
德国慕尼黑路德维希-马克西米利安大学弗里德里希-鲍尔研究所(Friedrich-­Baur-Institute)神经学副教授玛吉·C·沃尔特(Maggie C.Walter)在一份新闻稿中说:“尽管这些数据是从一项开放研究中产生的,但这些数据似乎支持在初级阶段3期试验中观察到的疗效信号,并表明在两年的过程中潜在的持续疗效。”
2015年12月,Pharnext开展了一项为期15个月的随机双盲3期临床试验,称为PLEO-CMT(NCT02579759),以研究PXT3003在323名年龄在16至65岁之间的CMT1A患者中的安全性和有效性。每天两次,低剂量或高剂量的PXT3003或安慰剂,每天早晚与食物一起口服。
该研究的主要目标是评估从基线到12个月和15个月治疗期结束期间身体残疾程度的变化(通过总体神经病限制量表(ONLS)进行测量)。
该公司于2018年10月宣布,PLEO-CMT达到了其主要目标,即证明在接受最高剂量PXT3003治疗的患者与接受安慰剂治疗的患者之间ONLS存在显着差异。
通过参加一项名为PLEO-CMT-FU(NCT03023540)的开放标签扩展研究,已完成试验的患者可以选择继续用PXT3003治疗。
在这项研究中,患者继续接受与最初给予的剂量相同的剂量(低剂量为D1或高剂量为D2)。接受安慰剂治疗的患者以1:1的比例随机分配,以最低剂量(P-D1组)或最高剂量(P-D2组)开始PXT3003治疗。
2017年9月,PXT3003的D2制剂出现意料之外的问题,导致D2组的停用以及这两项研究期间某些患者的临时治疗中断。
发生此事件后,那些在扩展研究中应接受D2制剂的患者接受了D1制剂体积的两倍,而那些从安慰剂转为PXT3003的患者则被分配了D1制剂。
在参与PLEO-CMT的323位参与者中,有187位决定参加扩展研究,其中185位符合条件,其中包括D1-D1组的62位,D2-D2组的69位,P-D1组的46位组和P-D2组中的八个。
扩展研究的9个月数据显示,与安慰剂组(P-D1和P-D2)相比,所有治疗组(D1-D1和D2-D2)的ONLS得分总体提高。此外,最初使用安慰剂治疗的患者在切换到PXT3003后,其ONLS得分显着提高。
来自研究的汇总数据显示,尽管在意料之外的平均中断治疗时间为平均五个月的情况下,使用两种剂量制剂治疗的患者在近25个月的治疗期间均经历了ONLS评分的改善或稳定。
尽管在D1-D1和D2-D2组的治疗中断期间ONLS得分有所下降,但在参与者恢复治疗后不久,它们的得分有所提高。Pharnext表示,过去25个月的累积变化显示ONLS改善了-0.26点。
“这些数据进一步增强了我们对先前临床研究中安全性和有效性信号的信心,” Pharnext的联合创始人兼首席执行官Daniel Cohen博士说。
Pharnext计划继续在扩展研究中给药,直到PXT3003可以商业购买。该公司还希望在今年晚些时候宣布这项研究的详细结果。
该公司目前正在与美国食品和药物管理局(FDA)讨论,以计划PXT3003的第二期3期试验。由于在PLEO-CMT中PXT3003的一种剂量制剂出现意外问题而导致数据丢失,因此FDA要求该公司进行这项额外的研究。这项新的3期临床试验的方案应在2020年上半年完成。
Pharnext还计划使用这项新的3期试验中的数据来支持欧洲PXT3003 的营销授权申请的提交。
“我们期待与美国食品和药物管理局继续进行讨论,并期望在2020年上半年进行一项额外的关键性3期临床试验的设计,以期尽快启动研究。”
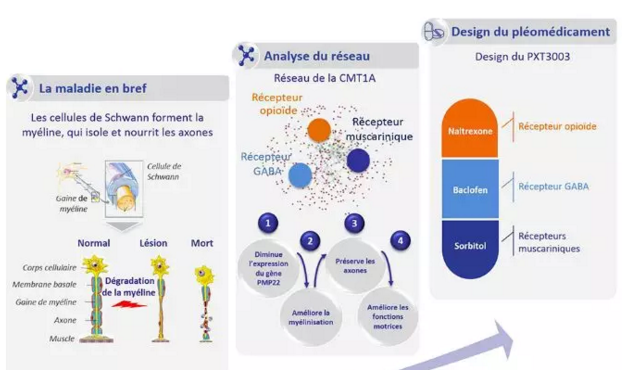
PXT3003是巴氯芬,纳曲酮和山梨糖醇的一种研究性联合疗法,这是三种已批准的作用于神经系统的疗法,被配制为口服溶液,每天两次。该疗法先前已获得FDA 的孤儿药称号和快速通道。