日前,罗氏(Roche)旗下基因泰克(Genentech)公司宣布,其口服SMN2基因剪接调节剂risdiplam,在治疗1型脊髓性肌萎缩症(SMA)患者的关键性3期试验FIREFISH的第2部分研究中,显著改善1至7个月婴儿患者的运动功能,达到试验的主要终点。去年11月,美国FDA已授予risdiplam优先审评资格。
SMA的发病根源在于一种被称为运动神经元生存蛋白(survival motor neuron, SMN)的缺失或失常。SMN蛋白对于维持人体运动神经元存活至关重要,人体内有两条可以生成SMN蛋白的基因,分别是SMN1基因和SMN2基因,但SMN1基因占主导作用,SMN2基因仅产生少量SMN蛋白(约10%)。因此,一旦SMN1基因功能失常,就会导致患者无法生成足够的运动神经元生存蛋白,患者运动神经元迅速死亡,肌肉功能逐步丧失,最终导致瘫痪,且无法完成吞咽、呼吸等维持生命的基本活动,严重威胁患者生命。虽然SMA主要是在婴幼儿期发病,但患者可能是从婴儿至成人的任何年龄段,临床上通常分为1型,2型和3型SMA,即婴儿型,中间型和成年型SMA。
Risdiplam(RG7916)是由基因泰克公司和PTC Therapeutics公司以及SMA基金会联合开发的一款口服SMN2基因剪接调节剂。它通过调节SMN2基因的mRNA剪接过程,提高SMN蛋白在中枢神经系统(CNS)和外周的表达。这一治疗SMA的策略与已经获批的Spinraza非常相似。不同之处在于Spinraza是使用反义寡核苷酸(ASO)调节RNA剪接,需要直接注射到脑脊液中。而risdiplam是一款小分子药物,可以口服使用。目前,它正在多项临床试验中治疗0至60岁不等的SMA患者。
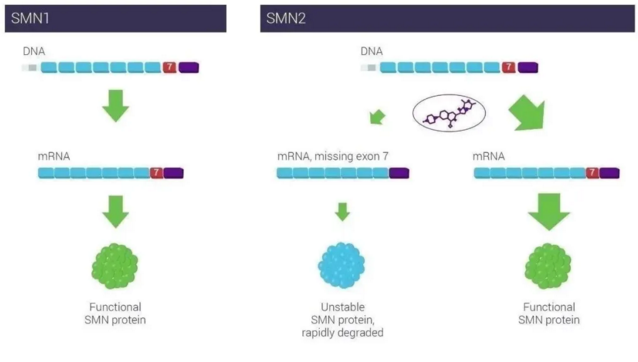
▲Risdiplam通过调节SMN2基因mRNA剪接提高SMN蛋白水平(图片来源:PTC Therapeutics公司官网)
在名为FIREFISH的临床试验中,1型SMA患者接受了不同剂量的risdiplam的治疗。试验的第1部分为剂量递增研究,而在试验的第2部分,患者接受预期治疗剂量的risdiplam的治疗。第2部分的试验结果表明,根据Bayley婴幼儿发展评估量表第三版(BSID-III)的评估,FIREFISH研究达到了其主要终点。接受治疗12个月时,有29%的婴儿患者在无支撑的情况下坐起了5秒,自然病史组中没有患者可以达到这一运动里程碑。此外,根据Hammersmith婴儿神经系统检查2(HINE-2)的测量,18例(43.9%)婴儿能够保持头部直立,13例(31.7%)能够向一侧翻滚,2例(4.9%)婴儿能够在支撑下站立。
“这些试验结果证实了risdiplam在患有晚期和难治性疾病的婴儿治疗中起到具有临床意义的疗效,”罗氏首席医学官兼全球产品开发主管Levi Garraway医学博士说:“我们感谢SMA疾病组织的合作,尤其是来自世界各地参与FIREFISH研究第1部分和第2部分的62个家庭。”
参考资料:[1] Genentech’s Risdiplam Shows Significant Improvement in Survival and Motor Milestones in Infants With Type 1 Spinal Muscular Atrophy (SMA). Retrieved 2020-04-28, from https://www.gene.com/media/press-releases/14847/2020-04-27/genentechs-risdiplam-shows-significant-i