4月30日,中国国家药监局药品审评中心(CDE)网站最新公示显示,葛兰素史克(GSK)公司已递交其重磅药belantamab mafodotin的临床试验申请,并获得CDE受理。该药已在2019年底向美国FDA递交了治疗复发难治性多发性骨髓瘤(MM)的上市申请。如果获批,belantamab mafodotin将成为FDA批准的首个靶向B细胞成熟抗原(BCMA)的药物。它曾获得美国FDA授予的突破性疗法认定、优先审评资格,以及欧洲药品管理局的PRIME认定。
MM是一种由于骨髓中的浆细胞癌变造成的血液肿瘤。癌变的浆细胞在骨髓中不断增生,不但影响正常红细胞和白细胞的生成,而且会造成不正常的抗体在体内过度积累。患者通常会出现骨痛、恶心、食欲下降、经常感染和贫血等症状。虽然目前有化疗、糖皮质激素和靶向药物等多种方法控制MM,但是仍然有很多患者的肿瘤会对所有目前获批的疗法产生抗性。这些患者迫切需要使用创新机制来控制MM的疗法。
BCMA是近年来非常热门的靶点之一,它是一种跨膜糖蛋白,属于肿瘤坏死因子(TNF)受体超家族,又被称为TNFRSF17或CD269。这一蛋白的重要特点是它在所有MM细胞上高度表达,而且它不在其它正常组织中表达(除了浆细胞)。作为一款抗体偶联药物(ADC),belantamab mafodotin将人源化抗BCMA抗体与细胞毒性剂连接在一起,通过靶向BCMA将细胞毒性剂特异性送入MM细胞中起到杀伤癌细胞的作用。
在一项名为DREAMM-2的关键性2期临床试验中,belantamab mafodotin治疗接受过多种前期疗法的复发/难治性多发性骨髓瘤(R/R MM)患者获得了积极结果。研究显示,belantamab mafodotin 2.5mg/kg剂量组的总缓解率为31%(30/97),3.4mg/kg剂量组的ORR为34%(34/99),数据具有临床意义。在2.5mg/kg剂量组里病情缓解的30例患者中,18例患者病情获得了非常好的部分缓解或更好的缓解(≥VGPR),包括3例获得了严格完全缓解(sCR)。
中位随访6个月,中位缓解持续时间(DoR)尚未达到,总生存期(OS)也尚未达到。也就意味着患者在经belantamab mafodotin治疗起效后,起效时间可以持续6个月以上。该研究的详细结果同步发表在《柳叶刀肿瘤学》(The Lancet Oncology)杂志上,同时也支持GSK在2019年底递交了新药申请。
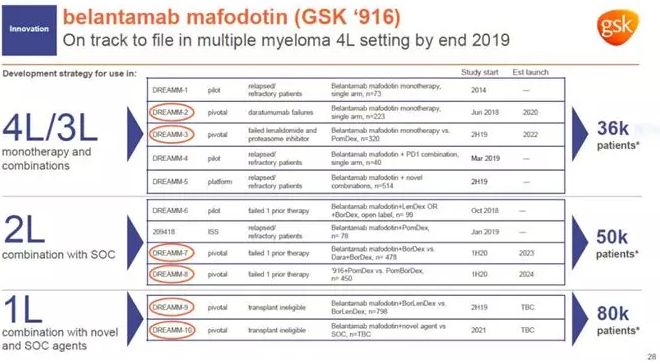
▲Belantamab mafodotin是GSK的一款潜在重磅疗法(图片来源:参考资料[2])
Belantamab mafodotin也被称为GSK2857916,是GSK公司的重点研发项目之一。除了单药治疗,该公司还计划探索belantamab mafodotin与其他标准疗法或新型药物联用作为MM一线和二线疗法的疗效。
过去十年来,人们在治疗MM方面已经取得了重大进展,但对于复发/难治性患者仍具有未竟需求。此次GSK公司将belantamab mafodotin这款重磅药带入中国,也意味着有可能为中国MM患者带来有效治疗选择。我们预祝这款新药在中国的临床研究进展顺利,从而早日惠及患者。