
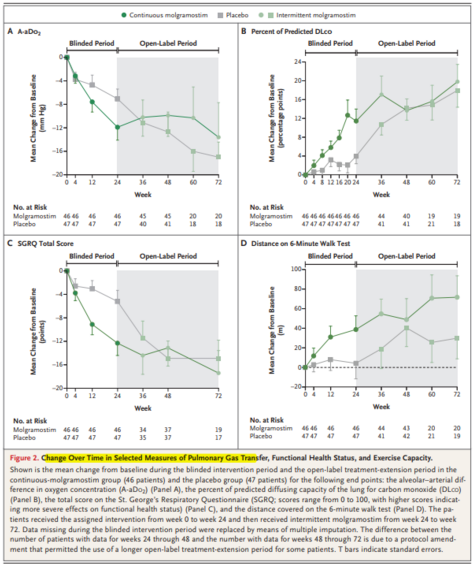
吸入莫拉司亭治疗自身免疫性肺泡蛋白沉积症 背 景:自身免疫性肺泡蛋白沉积症(Autoimmune pulmonary alveolar proteinosis,aPAP)是一种以进行性肺泡表面活性物质沉积和低氧血症为临床特征的罕见病。病因主要由粒细胞-巨噬细胞集落刺激因子(GM-CSF)信号通路障碍所致,其中肺泡巨噬细胞依赖GM-CSF参与清除肺泡表面活性物质。近年来,吸入GM-CSF被证实可以改善aPAP患者的动脉血氧分压。 方 法:这是一项随机双盲、安慰剂对照、三臂临床研究,aPAP患者被随机分配至3组,包括莫拉司亭(通用名:重组GM-CSF)持续给药组,300μg 每日1次吸入、或莫拉司亭间歇给药组,300μg,每日1次,(隔周给药),或安慰剂对照组。研究方案包括前24周治疗干预期及后续48周开放标签治疗延展期。主要研究终点是自基线至治疗第24周,肺泡气-动脉血氧分压差(A-aDo2)的变化值。 结 果:共138例aPAP患者随机分为3组,莫拉司亭持续给药组46例,莫拉司亭间歇给药组45例,安慰剂对照组47例;其中4例(持续给药组1例、间歇给药组1例和安慰剂组2例)因在动脉血气检测期间接受鼻吸氧治疗,列为无效(A-aDo2)数据。主要研究终点A-aDo2,即基线至治疗24周 A-aDo2变化值,持续给药组改善优于安慰剂组(-12.8 mm Hg vs. -6.6 mm Hg;组间差异,−6.2 mm Hg; P = 0.03)。次要研究终点,持续给药组改善也优于安慰剂组,其中包括基线至治疗24周,圣乔治呼吸问卷总分下降值(-12.4分vs.-5.1分;组间差异,−7.4分;P = 0.01)。基于多研究终点分析,莫拉司亭持续给药组获益优于间歇给药组。三组内发生不良事件和严重不良事件的患者比例相似,然而在莫拉司亭持续给药组中,胸痛发生比例高于其它组。 结 论:对于aPAP患者,每日吸入莫拉司亭治疗组较安慰剂对照组,更能有效改善患者肺内气体交换和功能健康状况,不良事件发生率没有显著统计学差异。(该研究由Savara制药公司资助;IMPALA ClinicalTrials.gov号,NCT02702180) 图1 基线至治疗24周肺泡气-动脉血氧分压差(A-aDo2)变化值。 如图所示,莫拉司亭持续给药组(46例)和安慰剂组(47例)在第24周时A-aDo2与基线相比差值。每个圆圈代表1名患者的数据结果。水平线代表均值,I条代表标准差。 图2 基于治疗干预后的肺内气体交换、功能健康状况和运动耐量变化 图中所示是莫拉司亭持续给药组(46例)和安慰剂组(47例)在随机治疗干预期和开放标签治疗延展期的自基线之平均变化均值:肺泡-动脉血氧浓度差(A-aDo2)(Panel A),DLco弥散量占预计值百分比(Panel B),圣乔治呼吸问卷总分(George's Respiratory Questionnaire,SGRQ:范围从0到100,分数越高表示对功能健康状态之影响越严重)(Panel C),及6分钟步行测试距离(Panel D)。所有患者从基线至第24周随机接受分组治疗干预,后从第24周至第72周开放延展期,均接受莫拉司亭间歇给药治疗。在治疗双盲干预期,数据缺失通过多重归因方式替换分析。部分患者第24至48周研究数据与第48至72周研究数据之差异,基于更长期之开放标签治疗延展期相关研究方案修订细则。T条表示标准差。 专家点评 肺泡蛋白沉积症(PAP)是一种相对常见的呼吸系统罕见病,是主要以肺泡表面活性物质在肺泡腔内大量沉积为特征的慢性疾病[1]。近年来,国内外基础研究发现,其发病机制主要是由于巨噬细胞对肺泡表面活性物质清除障碍或肺泡表面活性物质产生异常所致。据此,临床上可分为以下类型:①特发性PAP,即GM-CSF信号通路异常所致,主要包括抗GM-CSF抗体阳性的自身免疫性PAP(又称aPAP),约占85-90%,和遗传性PAP,属于常染色体隐性遗传病, 目前认为与CSF2RA或CSF2RB基因变异相关;②继发性PAP,常见继发于血液病、免疫缺陷病、慢性感染等;③先天性PAP,主要见于新生儿,由于SFTPB、SFTPC和ABCA3 等基因变异导致肺泡表面活性物质产生异常所致;此外,极少数原因不明PAP,可归为未分类PAP[1, 2]。目前据估计,全球PAP总体患病率约为7人/百万左右。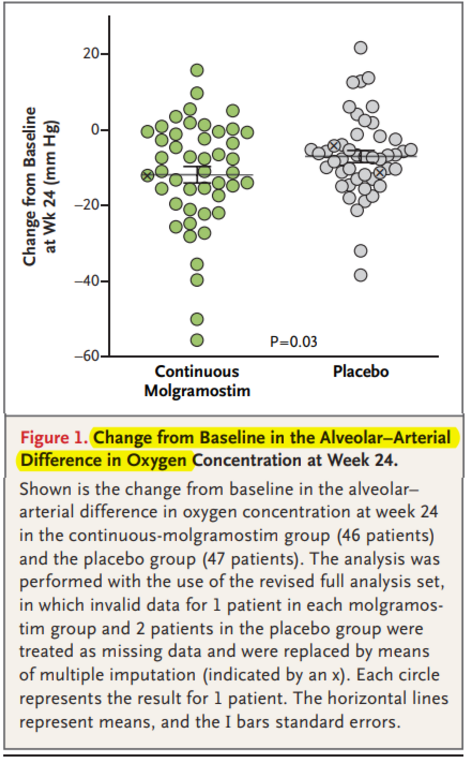
众所周知,肺泡蛋白沉积症目前尚无特异性治疗方法。目前治疗主要以对症治疗为主,即针对性清除肺泡腔内沉积的蛋白样物质。近年来,用双腔气管插管进行大容量全肺灌洗(whole lung lavage,WLL)可获得较好疗效[1, 3, 4]。然而,肺灌洗后部分PAP患者存在复发和再次加重,需要再次灌洗或多次灌洗。全肺灌洗的中位有效时间为15个月[1]。由于WLL的有效率约为70%~84%,且多数患者需要重复灌洗,同时,较多医疗单位对肺灌洗的适应症、时机、流程、并发症、随访等尚不熟悉及缺乏行业内的统一标准,临床推广存在困难。
近年来,国内外临床研究发现外源性补充GM-CSF可以有效治疗aPAP。1996年Seymour等报道了首例皮下注射GM-CSF治疗PAP有效的病例之后,越来越多的PAP患者开始使用GM-CSF治疗。2011年Khan发表了一篇荟萃分析,总结了2011年之前发表的所有GM-CSF治疗PAP的疗效及安全性研究。结果发现,吸入给药无论从有效率、复发率还是安全性方面,都优于皮下给药。2019年9月,日本学者在新英格兰医学杂志发表PAP研究领域首项多中心、随机、双盲安慰剂对照临床研究[5],即PAGE研究,结果显示吸入重组人GM-CSF对aPAP患者动脉血氧分压有适度获益,但未观察到明确临床获益,该研究不足之处在于,只讨论轻度至中度aPAP患者,样本量限制及单一治疗剂量,吸入装置的影响等。 本文是2020年9月新英格兰医学杂志发表关于吸入GM-CSF治疗aPAP[6]的大样本、国际多中心、随机双盲、安慰剂对照临床试验,即IMPALA研究,结果发现持续莫拉司亭吸入治疗可有效改善aPAP患者气体交换,并首次证实吸入GM-CSF可使aPAP患者临床获益。此外,每天一次,持续给药的治疗方式,也为aPAP治疗提供了全新的治疗方案和选项。 原文摘要 参考文献 [1]. Trapnell BC, Nakata K, Bonella F, Campo I, Griese M, Hamilton J, et al. Pulmonary alveolar proteinosis[J]. Nature reviews Disease primers, 2019,5(1):16. [2]. Sakaue S, Yamaguchi E, Inoue Y, Takahashi M, Hirata J, Suzuki K, et al. Genetic determinants of risk in autoimmune pulmonary alveolar proteinosis[J]. Nature communications, 2021,12(1):1032. [3]. Beccaria M, Luisetti M, Rodi G, Corsico A, Zoia MC, Colato S, et al. Long-term durable benefit after whole lung lavage in pulmonary alveolar proteinosis[J]. The European respiratory journal, 2004,23(4):526-31. [4]. Seymour JF, Presneill JJ. Pulmonary alveolar proteinosis: progress in the first 44 years[J]. American journal of respiratory and critical care medicine, 2002,166(2):215-35. [5]. Tazawa R, Ueda T, Abe M, Tatsumi K, Eda R, Kondoh S, et al. Inhaled GM-CSF for Pulmonary Alveolar Proteinosis[J]. The New England journal of medicine, 2019,381(10):923-32. [6]. Trapnell BC, Inoue Y, Bonella F, Morgan C, Jouneau S, Bendstrup E, et al. Inhaled Molgramostim Therapy in Autoimmune Pulmonary Alveolar Proteinosis[J]. The New England journal of medicine, 2020,383(17):1635-44.