今年6月,Evrysdi(艾满欣®,利司扑兰)在中国获批上市:可在家服药,治疗广泛SMA患者(1/2/3型)。

SMA男孩(图片来自:drpgx.com)
罗氏(Roche)近日宣布,评估口服药物Evrysdi®(中文商品名:艾满欣®,通用名:risdiplam,利司扑兰口服溶液用散)治疗脊髓性肌萎缩症(SMA)全球性2/3期FIREFISH研究(NCT02913482)第2部分的数据,已发表于国际医学期刊《新英格兰医学杂志》(NEJM)。详见:Risdiplam-Treated Infants with Type 1 Spinal Muscular Atrophy versus Historical Controls。
SMA是导致婴幼儿死亡的首要遗传因素,5q-SMA是最常见的类型,该病可导致肌肉无力和进行性运动功能丧失,存在着重大的未满足医疗需求。Evrysdi于2020年8月获得美国FDA批准,用于治疗年龄≥2个月的SMA儿童和成人患者。2021年3月,Evrysdi获得欧盟批准,治疗年龄≥2个月、临床诊断为1型/2型/3型SMA或携带1-4个SMN2拷贝的5q型SMA患者。在中国,今年6月,Evrysdi(艾满欣®,利司扑兰口服溶液用散)获得国家药监局批准,用于治疗2月龄及以上SMA患者。截至目前,Evrysdi已在54个国家获得批准,并在另外33个国家提交了上市申请。
Evrysdi是第一个治疗SMA的口服疗法,也是第一个可在家给药的SMA疗法。该药是一种液体制剂,可在家通过口服或饲管给药,每日一次,该药可用于治疗所有类型(1型、2型、3型)SMA的婴幼儿、儿童、青少年、成人患者。Evrysdi是一种运动神经元生存基因2(SMN2)mRNA剪接修饰剂,通过提高运动神经元生存蛋白(SMN)的产生来治疗SMA。SMN蛋白遍布全身,对维持健康的运动神经元和运动至关重要。
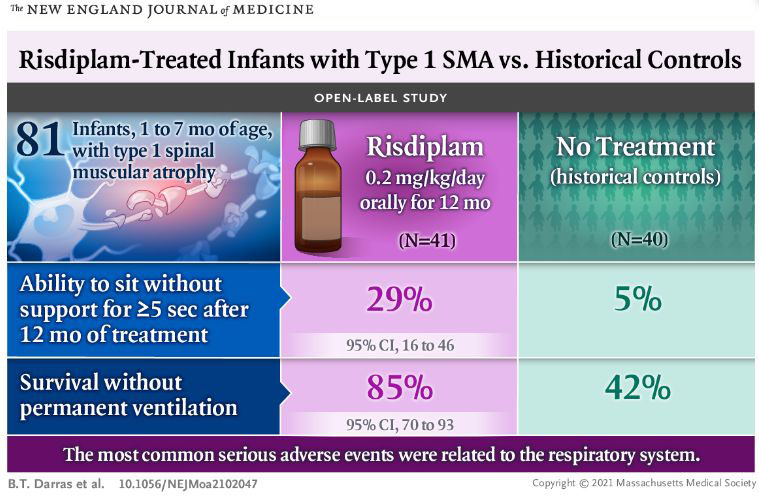
FIREFISH研究第2部分在入组时年龄为1-7个月大的有症状1型SMA婴儿中开展。结果显示,研究达到了主要终点:治疗12个月时,29%的婴儿(12/41)在没有支撑的情况下坐立至少5秒钟,这是疾病自然病程中从未见过的里程碑。FIREFISH研究第2部分中,Evrysdi的安全性与其已知的安全性特征一致。2021年2月,FIREFISH研究第1部分剂量发现的12个月结果发表在NEJM上。
FIREFISH研究员和、MDUK牛津神经肌肉中心儿科神经肌肉疾病教授Laurent Servais表示:“如果不进行治疗,患有1型SMA的婴儿不可能存活超过2岁。通过Evrysdi治疗实现的重要运动里程碑,如坐姿、翻身和吞咽,是帮助这些婴儿达到最佳效果的基本要素,有潜力减少永久通气需求、提高存活率。”
FIREFISH研究第2部分结果(图片来源于NEJM)
在数据分析时,Evrysdi治疗的平均持续时间为15.2个月,患者平均年龄为20.7个月。在治疗第12个月时,93%(38/41)的婴儿存活,85%(35/41)的婴儿没有永久性通气。而在未经治疗的情况下,自然疾病史队列中死亡或永久性通气的中位年龄为13.5个月。90%(37/41)的患者CHOP-INTEND评分至少增加了4分,56%(23/41)患者评分超过40分,中位增幅为20分。
此外,该研究达到了次要终点之一:78%(32/41)的患者被归类为HINE-2应答者。HINE-2量表(Hammersmith婴儿神经学检查量表2)通过头部控制、坐姿、自主抓握、踢腿、滚动、爬行、站立和行走的能力来评估运动功能。如果更多的运动里程碑显示改善而不是恶化,婴儿被归类为HINE-2应答者。
在FIREFISH第2部分研究中,Evrysdi的安全性与其已知的安全性特征一致。最常见的不良事件为上呼吸道感染(68%)、肺炎(39%)、发热(39%)、便秘(20%)、腹泻(10%)和斑丘疹(10%)。最常见的严重不良事件为肺炎(32%)、毛细支气管炎(5%)、张力过低(5%)和呼吸衰竭(5%)。3名婴儿在治疗的前3个月内出现了致命的并发症。研究者认为这些都与Evrysdi无关。
今年4月,罗氏公布了FIREFISH研究第2部分新的2年数据,显示:在12个月至24个月期间,Evrysdi继续改善婴儿的运动功能,包括无支撑坐立的能力。研究还表明,Evrysdi继续提高存活率,提高口服喂养能力,减少对永久性通气的需要。探索性数据表明,与1型SMA的自然病程相比,Evrysdi继续改善吞咽能力、减少住院率。Evrysdi的安全性符合其既定的安全状况。
罗氏首席医疗官兼全球产品开发负责人Levi Garraway医学博士表示:“这些发表在《新英格兰医学杂志》上的数据验证了FIREFISH研究第一部分的结果,表明Evrysdi可以帮助SMA婴儿达到重要的里程碑,即:在没有支撑的情况下坐立至少5秒钟。最近公布的24个月数据进一步证实了这些结果,显示Evrysdi继续改善运动功能,从12个月起,能够在没有支持的情况下坐立的婴儿数量翻了一番。我们将继续与政府和SMA社区密切合作,使Evrysdi尽可能多地惠及更多的患者。”

Evrysdi-risdiplam化学结构(图片来源:medchemexpress.cn)
Evrysdi是一种口服液体,其活性药物成分risdiplam是一种运动神经元存活基因2(SMN2)剪接修饰剂,旨在持续增加和维持中枢神经系统和外周组织中的SMN蛋白水平。越来越多的临床证明表明,SMA是一种多系统疾病,SMA蛋白的丢失可能影响中枢神经系统以外的许多组织和细胞。risdiplam口服给药后呈现全身性分布,可持续增加中枢神经系统和外周组织的SMN蛋白水平,已显示出可改善1型、2型、3型SMA患者的运动功能。来自关键临床试验的数据证实,Evrysdi对2个月及以上的婴儿、儿童、成人患者均有效,在不同年龄和疾病严重程度(包括1型、2型、3型)SMA患者中均使运动功能获得临床意义的改善。接受Evrysdi治疗的婴儿,能够在没有支撑的情况下坐立至少5秒钟,这是SMA疾病自然病程中无法实现的关键运动里程碑。此外,与自然病史相比,Evrysdi还提高了无永久通气生存率。
作为与SMA基金会及PTC Therapeutics公司合作的一部分,罗氏领导了Evrysdi的临床开发。目前,在临床试验、同情使用和现实环境中,有4000多名患者接受了Evrysdi治疗。
作为SMA领域一项大规模、广泛、稳健临床试验项目的一部分,Evrysdi正在超过450人中进行研究。该项目涵盖了2个月大的婴儿到60岁的老年人,他们有不同的症状和运动功能,例如脊柱侧凸或关节挛缩,也包括先前接受过其他SMA疗法的患者。该药的临床试验人群旨在代表广泛的、现实世界中的SMA疾病人群,目的是确保所有适合的患者都能获得治疗。
当前,罗氏正在开展4项全球性多中心临床研究(SUNFISH[NCT02908685]、FIREFISH[NCT02913482]、JEWELFISH[NCT03032172]、RAINBOWFISH[NCT03779334]),评估Evrysdi治疗所有类型(1型、2型、3型)SMA以及新生儿症状前SMA的疗效和安全性。
Spinraza:全球首个SMA治疗药物,已在中国获批
SMA是一种会导致肌肉无力和萎缩的运动神经元性疾病,该病属于基因缺陷导致的常染色体隐性遗传病,对患者周身上下的肌肉都会造成侵害,患者主要表现为全身肌肉萎缩无力,身体逐渐丧失各种运动功能,甚至是呼吸和吞咽。SMA是2岁以下婴幼儿群体中的头号遗传病杀手,该病是一种相对常见的“罕见病”,在新生儿中的患病率为1:6000-1:10000。据相关报道,目前中国SMA患者人数大约3-5万人。
2016年12月,来自渤健与合作伙伴Ionis开发的药物Spinraza(nusinersen,诺西那生钠注射液)获批,成为全球首个治疗SMA的药物。该药是一种反义寡核苷酸(ASO),通过鞘内注射给药,将药物直接递送至脊髓周围的脑脊液(CSF)中,改变SMN2前信使RNA(pre-mRNA)的剪接,增加全功能性SMN蛋白的产生。在SMA患者中,SMN蛋白水平不足导致脊髓运动神经元功能退化。在临床研究中,Spinraza治疗显著提高了SMA患者的运动机能。
2019年5月,来自诺华的基因疗法Zolgensma(onasemnogene abeparvovec)获批,成为全球首个治疗SMA的基因疗法。该药通过单次、一次性静脉输注后持续表达SMN蛋白来阻止疾病进程,可解决SMA的根本病因,有望长期改善患者生存质量。
在中国,Spinraza(nusinersen,诺西那生钠注射液)于2019年2月底获批,用于5q脊髓性肌萎缩症(5q-SMA)患者的治疗。此次批准,使Spinraza成为中国市场首个治疗SMA的药物。5q-SMA是SMA的最常见类型,约占全部SMA病例的95%,该类型SMA是由5号染色体上的SMN1(运动神经元生存蛋白1)基因突变所引起的,因此得名5q-SMA。
原文出处:Data for Roche’s Evrysdi® (risdiplam) published in New England Journal of Medicine shows significant improvement in survival and motor milestones in babies with Type 1 spinal muscular atrophy (SMA)