庞贝病临床主要影响骨骼肌和平滑肌、心肌、肺和胃肠系统,rhGAA酶替代治疗(ERT)是其临床治疗的主要方法,但仍然存在很多局限性,我们节选2项针对晚发性庞贝病(LOPD)的ERT随访数据,可以发现酶替代治疗对肌力的最大改善作用可能在维持治疗2-3年左右(图1、2)。
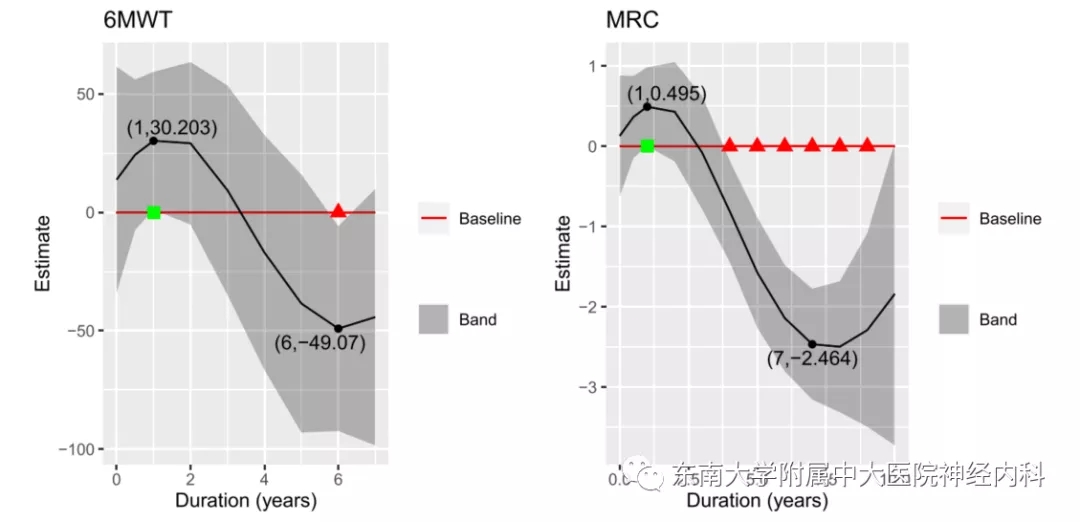
图1. 14名LOPD患者酶替代治疗后病程随访的95%置信区间。左图为6分钟步行距离百分比,右图为徒手肌力检查绿色方块代表显著改善,红色三角代表显著恶化。
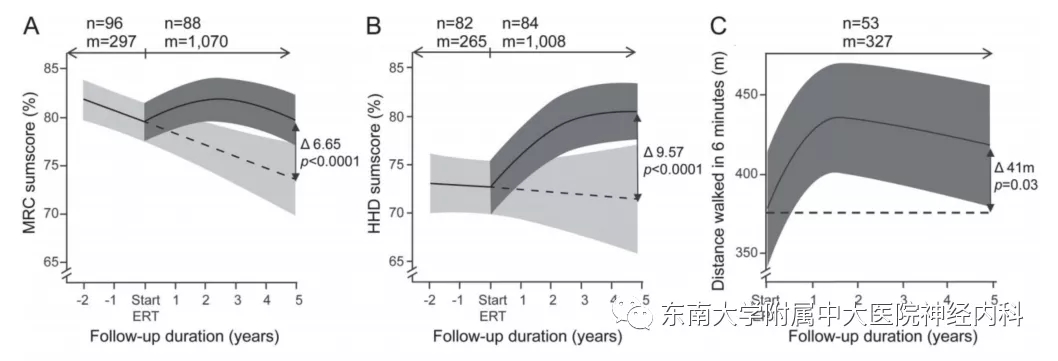
图2. ERT治疗前后LOPD组水平病程随访的95%置信区间。A图徒手肌力检查,B图握力计检查,C图6分钟步行距离。实线为自然病程和用药后变化,虚线为根据自然病程的推测未用药病程。m,评估肌肉数;n,人数。
因此在新的酶替代药物或基因治疗药物出现之前,更好的监测患者状态,评估受累脏器功能,选用合适的对症治疗药物,就显得尤为重要。我们的公众号也将在后续文章中重点关注这部分内容,深入介绍评估内容和药物合并使用策略。庞贝病患者心脏是最常受累器官,由于心肌破坏,心脏重构、内膜缺血、冠脉灌注不足、慢性缺氧、二氧化碳潴留等原因,导致快速型心律失常成为最常见的表型之一,如心房纤颤、室上性心动过速、窦性心动过速等,β受体阻滞剂是临床最常应用的药物,但目前的研究表明部分β受体阻滞剂可能并不适于庞贝病患者。
早在2005版《庞贝病的诊断和治疗指南》中,即提醒注意β受体阻滞剂可能导致庞贝病患者死亡。Han SO等使用GAA敲除(GAA-KO)构建的庞贝病小鼠模型和庞贝病患者成纤维细胞进一步开展了研究。研究团队发现在连续给予GAA敲除构建的庞贝病小鼠模型相应处理5周后,与单独使用ERT或ERT联合β受体激动剂克伦特罗干预的小鼠相比,经β受体阻滞剂普萘洛尔+ERT干预的GAA-KO小鼠出现疾病且体重未增加、腓肠肌重量稍减轻,提示肌肉萎缩。左心室重量/体重没有产生有意义的降低,而ERT对心肌肥厚的疗效已被证实,提示普萘洛尔的使用阻碍了ERT对心脏的有效干预(图3)。ERT+普萘洛尔的干预旋转潜伏期,提示GAA-KO小鼠肌肉功能的改善。而相对ERT+克伦特罗的肌肉改善作用,ERT+普萘洛尔不能改善小鼠的悬笼潜伏期。在小鼠肝脏中可以发现ERT+普萘洛尔抑制了ERT本身对心肌和骨骼肌中糖原的清除作用(图4)。以上研究结果表明,在ERT干预期间联合普萘洛尔,虽然可提高肌肉对rhGAA的摄取,但糖原累积明显增加,以心肌、膈肌最甚,不能实现单用ERT治疗的改善作用。
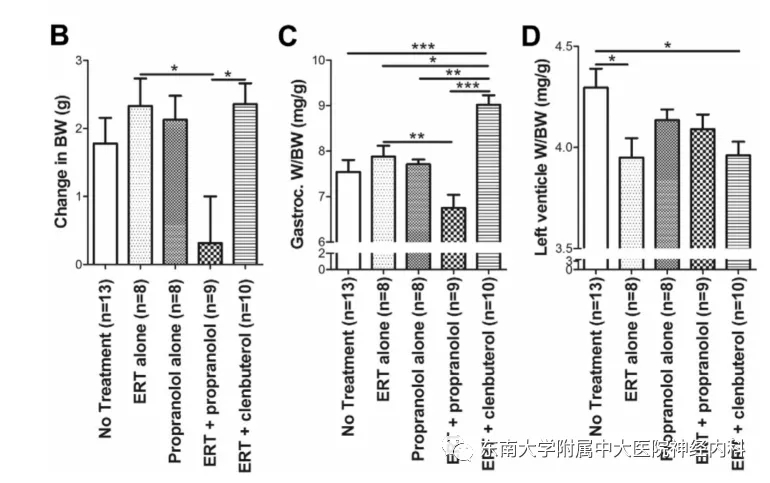
图3,GAA-KO小鼠体重、腓肠肌重量和左心室心肌重量评估。
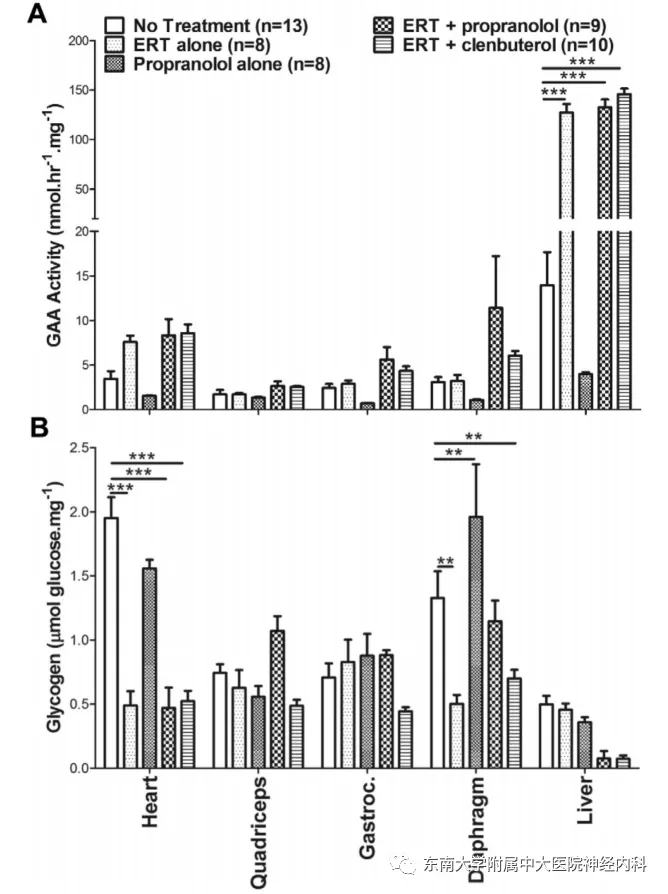
图4. 各组织成分中,不同干预方法GAA活性和糖原成分测定
对庞贝病患者成纤维细胞(GM04912)溶酶体酶活性的研究发现,普萘洛尔可呈剂量依赖性的降低细胞对培养基中rhGAA的摄取(图5)。
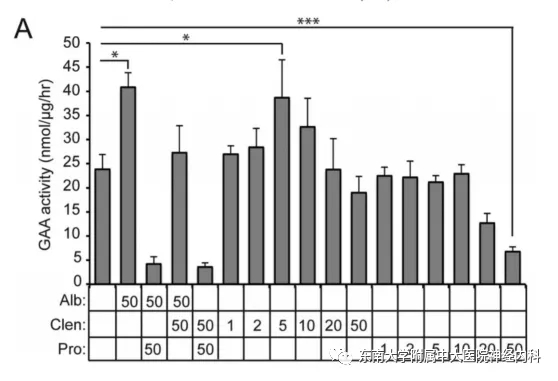
图5. 沙丁胺醇(Alb)、克伦特罗(Clen)和普萘洛尔(Pro)对成纤维细胞溶酶体中摄入的rhGAA活性的影响。
rhGAA进入骨骼肌需要依赖于不依赖阳离子的甘露糖6-磷酸受体(CI-MPR)。该研究团队后续研究发现β受体阻滞剂卡维地洛和普萘洛尔对CI-MPR和LC3的作用不同,在给予ERT干预后,联合克伦特罗和卡维地洛均可降低CI-MPR浓度,提示由于摄取rhGAA,CI-MPR被中和或降解,而普萘洛尔没有这种作用。而且卡维地洛可降低积累的自噬体(降低的LC3)(图6.)。尽管可以部分增加心肌rhGAA的摄入,并改善腓肠肌肌、心肌的重量,但联合卡维地洛较单用ERT干预,可能导致心肌糖原成分的增加,并导致抗rhGAA IgG1的滴度升高。
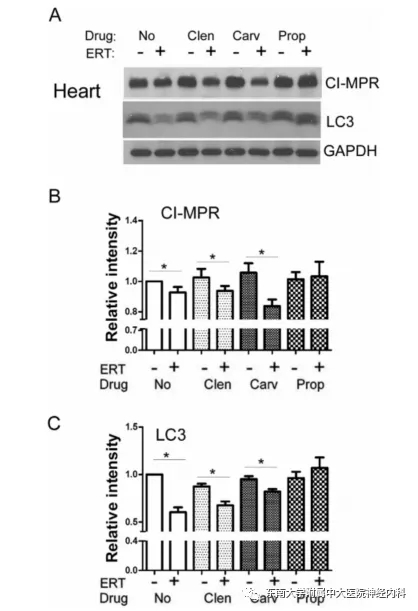
图6. 心肌CI-MPR和LC3的Western Blot分析。
上述动物研究中,未发现非选择性β受体阻滞剂卡维地洛和普萘洛尔联合ERT治疗的显著优势,并且普萘洛尔甚至会影响ERT的干预效果,加上指南中提及的β受体阻滞剂可能导致庞贝病患者死亡。因此,我们建议庞贝病患者避免使用β受体阻滞剂药物来控制心率、改善心功能。
by:东南大学附属中大医院神经内科罕见病诊治团队
参考文献
1. Kuperus,E. et al. Long-term benefit of enzyme replacement therapy in Pompedisease: A 5-year prospective study. Neurology 89, 2365–2373(2017).
2. Papadimas, G. K. et al. Effect of long term enzymereplacement therapy in late onset Pompe disease: A single-centre experience. Neuromuscul.Disord. 31, 91–100 (2021).
3. Han, S. et al. A beta-blocker, propranolol, decreases theefficacy from enzyme replacement therapy in Pompe disease. Mol. Genet.Metab. 117, 114–119 (2016).
4. Han, S. et al. Evaluation of antihypertensive drugs incombination with enzyme replacement therapy in mice with Pompe disease. Mol.Genet. Metab. 129, 73–79 (2020).