2021年8月6日,美国FDA宣布批准赛诺菲(Sanofi)的酶替代治疗(ERT)药物Nexviazyme(avalglucosidase alfa-ngpt,neoGAA)上市,用于治疗1岁及以上的晚发性庞贝病(late-onset Pompe disease,LOPD)患者。
众所周知,重组人阿糖苷酶α(rhGAA)是庞贝病的目前最有效的临床治疗药物。但其存在很多问题,下图可反映rhGAA进入溶酶体的过程。首先血液循环中的rhGAA穿过内皮细胞和间质组织,到达受累肌肉的效率极低。其次rhGAA通过甘露糖-6-磷酸(M6P)与阳离子依赖的M6P受体(CI-MPR)结合,但其捕获的M6P有限。最后骨骼肌包膜的CI-MPR表达量较低。我们前文也已提到随访研究中应用rhGAA的酶替代治疗(ERT)对肌力的最大改善作用可能在维持治疗2-3年左右,并逐渐减弱。因此从不同环节提高rhGAA进入细胞并转运至溶酶体,成为剂型改良的关键。
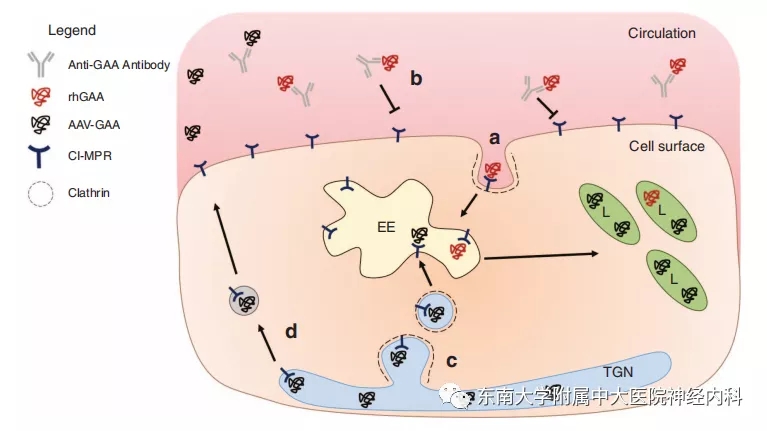
图1. a. rhGAA通过CI-MPR进入初级内体(EE),继而融合入溶酶体(L)。b. 血液循环中会产生高滴度的针对rhGAA的抗体。
在此需求下,赛诺菲公司研制了第二代酶替代治疗(ERT)药物neoGAA,其本质为希望通过提高M6P的水平,增加进入溶酶体的酶数量,从而更好的改善骨骼肌功能。临床前研究中,与rhGAA相比较,neoGAA与CI-MPR的亲和力提高1000倍,可以更好的分解骨骼肌细胞中的糖原。其3期临床实验COMET(NCT02782741)是一项双盲头对头研究,在晚发型庞贝病(LOPD)患者中开展。研究中,患者随机分配,接受neoGAA或rhGAA治疗,剂量均为20mg/kg,每2周静脉输注一次。结果表明,治疗近一年(49周)期间,neoGAA使LOPD步行距离和呼吸功能指标显著改善(具体见NCT02782741 - ClinicalTrials.gov)。该项目针对50-145周的有效性仍在进行。但neoGAA仍不能解决ERT治疗的所有问题,比如十分重要的免疫原性问题,这也是庞贝病目前和未来治疗过程中,临床医生需要重点思考解决的部分。
neoGAA在7月26日和8月6日,分别获得CHMP和FDA的批准,让我们看到了罕见病药物临床审批的高效性,给患者更多的希望。我们也期待neoGAA可以获得更好的临床疗效,并尽快引入国内。
参考文献
1. Pena, L.D. M. et al. Safety, tolerability, pharmacokinetics, pharmacodynamics,and exploratory efficacy of the novel enzyme replacement therapyavalglucosidase alfa (neoGAA) in treatment-naïve and alglucosidase alfa-treatedpatients with late-onset Pompe disease: A phase 1, open-label, multicenter,multinational, ascending dose study. Neuromuscul. Disord. 29,167–186 (2019).
2. Doerfler, P. A. et al. Targeted approaches to induceimmune tolerance for Pompe disease therapy. Mol. Ther. - Methods Clin. Dev.3, 15053 (2016).
3. Zhu, Y. et al. Glycoengineered Acid α-Glucosidase WithImproved Efficacy at Correcting the Metabolic Aberrations and Motor FunctionDeficits in a Mouse Model of Pompe Disease. Mol. Ther. 17,954–963 (2009).
注:本文旨在介绍医药健康研究进展,不是治疗方案推荐。如需获得治疗方案指导,请前往正规医院就诊。