蓝鸟生物(bluebird)8月10日公布了2021Q2财报,其中提到FDA暂停了其基因疗法elivaldogene autotemcel (eli-cel, Lenti-D™) 用于脑肾上腺脑白质营养不良 (CALD)的III期临床试验。
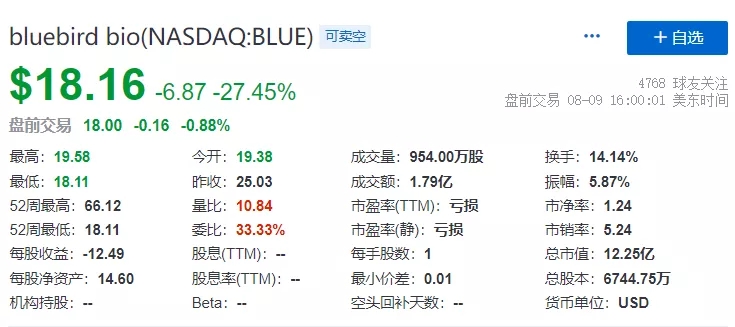
临床试验暂停让投资者纷纷抛售,bluebird的股价在8月9日的交易中下跌超过 25%,收盘价至18.16美元/股。
财报中提到,一份骨髓增生异常综合征(MDS) 疑似意外严重不良反应 (SUSAR)的报告显示,可能是由 Lenti-D 慢病毒载体 (LVV) 插入介导引起。目前蓝鸟生物已与该研究的独立数据监测委员会共享了此信息,并且FDA已将 eli-cel置于临床搁置状态。
今年7月21日,欧盟委员会已批准其一次性基因疗法Skysona(elivaldogene autotemcel,Lenti-D)上市,用于治疗18岁以下、携带ABCD1基因突变且没有HLA匹配的同胞造血干细胞(HSC)供体可用的早期脑肾上腺脑白质营养不良(CALD)患者。而如今FDA对该项目的叫停,无疑是基因疗法领域的一场打击。
蓝鸟生物称,临床搁置不会影响其镰状细胞病 (SCD)、β-地中海贫血及肿瘤学项目。根据公司保留的临床解决方案,预计在2021年完成eli-cel的滚动BLA 提交。
2021年1月,bluebird 宣布打算拆分为两个独立的上市公司(bluebird bio 和 2seventy bio),该公司预计分拆将于2021年底完成。
版权声明:本网站所有注明“来源:罕见病信息网”的文字、图片和音视频资料,版权均属于罕见病信息网网站所有。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。