多发性硬化(MS,图片来源:medgadget.com)
渤健(Biogen)近日宣布,欧洲药品管理局(EMA)人用医药产品委员会(CHMP)已发布一份积极审查意见,推荐批准Vumerity(diroximel fumarate),该药是下一代口服富马酸,用于治疗复发缓解型多发性硬化(RRMS)成人患者。据估计,全球有280万人患有MS,其中一些欧洲国家的MS患病率为全球最高。现在,CHMP的意见将递交至欧盟委员会(EC)审查,后者通常会在2个月内做出最终审查决定。
Vumerity是一种新型口服富马酸药物,具有独特的化学结构。该药由Alkermes研制,渤健拥有Vumerity商业化的独家全球授权。
在美国,Vumerity于2019年10月获得批准,用于治疗复发型多发性硬化(RMS),包括:临床孤立综合征、复发缓解型疾病和活动性继发进展型疾病。目前,Vumerity已成为美国市场处方量排名第一的口服MS疗法。自上市以来,现实世界数据已加强了Vumerity的积极胃肠道(GI)耐受性,并确认临床试验中的治疗体验与临床实践中的体验一致。

Vumerity属于免疫抑制剂,每日口服2次,属于控释剂型的富马酸单甲酯(MMF)前药,可在体内快速转化为MMF,MMF具有免疫调节和神经保护作用。多发性硬化(MS)的神经元变性与氧化应激有关,MMF具有抗氧化性能,可能有助于保护髓鞘、绝缘神经纤维。具体而言,MMF激活Nrf2通路,参与细胞对氧化应激的反应,可能保护神经元细胞免受损伤。MMF的免疫调节作用可能与抑制核因子-κB(NF-kB)介导的通路有关,而核因子-κB在免疫系统中起着关键作用。
Vumerity是渤健已上市药物Tecfidera(dimethyl fumarate,DMF,富马酸二甲酯)的升级版,具有改善的胃肠道耐受性。在临床研究中已被证实具有良好的疗效、安全性和耐受性。Vumerity因与Tecfidera的化学结构差异而具有差异化的胃肠道(GI)耐受性。Tecfidera在体内可转化为MMF发挥作用,该药推荐起始剂量为每次120mg、每日2次、持续7日,之后维持剂量为每日240mg、每日2次、随餐或空腹服用均可。
CHMP的积极审查意见,基于比较Vumerity和Tecfidera以建立生物等效性的药物动力学桥接研究的数据,并部分基于Tecfidera已建立的良好长期安全性和有效性特征。CHMP也评估了来自EVOLVE-MS-2研究的结果,这是一项大规模、随机、双盲、5周多中心3期研究,评估了Vumerity与Tecfidera在RRMS患者中的胃肠道(GI)耐受性。结果显示,Vumerity组总的治疗中断率低于Tecfidera组(1.6% vs 6%),因GI耐受性导致的治疗中断率也较低(0.8% vs 4.8%)。
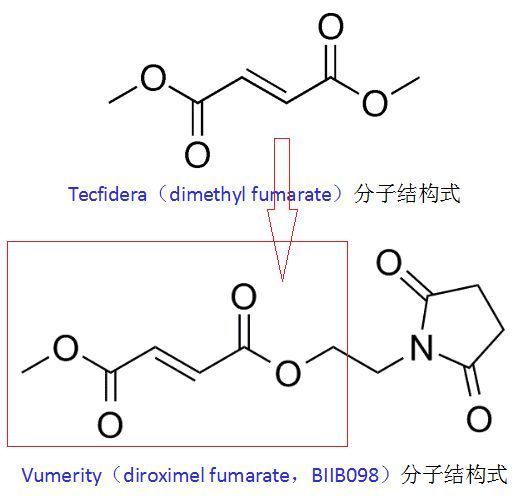
Vumerity与Tecfidera结构差异(图片来源:vumerityhcp.com)
EVOLVE-MS-2是一项多中心、双盲、阳性药物对照、为期5周的III期研究,在506例复发缓解型多发性硬化症(RRMS)患者中开展,旨在评估Vumerity相对于Tecfidera的耐受性,包括持续时间和严重程度。研究主要终点评估了在个体胃肠道症状及影响量表(IGISIS)评分表上症状强度评分≥2的GI症状的患者报告天数。次要终点评估整个研究群体中患者报告的IGISIS强度评分≥1或≥3 GI症状的天数(相对于暴露),仅B部分患者中IGISIS强度评分≥2 GI症状天数,整个研究群体中总体胃肠道症状和影响量表(GGISIS)强度评分≥1、≥2或≥3 GI症状天数,按研究周的最差(即最高)IGISIS个别症状评分。完成5周治疗期的患者有资格参加EVOLVE-MS-1,这是针对Vumerity的一项为期96周的开放标签安全性研究。
值得一提的是,EVOLVE-MS-2是第一项直接比较2种RMS治疗药物GI耐受性的研究。结果显示,与Tecfidera相比,Vumerity与五种主要GI症状的持续时间、严重程度和每日影响显著缩短相关。主要终点的结果显示,与Tecfidera相比,Vumerity治疗的患者自我报告的IGISIS强度评分≥2的天数减少了46%(调整后的比值比[95%CI]:0.54[0.39-0.75],p=0.0003)。IGISIS是一种新的探索性量表,用于患者自我评估主要胃肠道症状的强度和持续时间,包括恶心、呕吐、上下腹痛和腹泻。在该研究中,Tecfidera观察到的结果与该药已知的安全性一致。
此外,结果还表明,与Tecfidera相比,Vumerity治疗的患者:(1)因GI不良事件(AE)导致的停药率低(0.8% vs 4.8%);(2)IGISIS强度评分≥1和≥3的天数较少(相对减少29%,相对减少44%);(3)在总体胃肠道症状和影响量表(GGISIS)中,自我报告的强度评分≥1(减少30%)的天数较少,该量表评估了胃肠道症状的总体强度、对日常活动的影响以及它们的烦扰程度。GGISIS强度评分≥2和≥3的天数也较少。(4)在五周治疗期间,最差IGISIS强度评分逐渐下降。
上述采用患者评估症状强度量表的结果,得到了较低的研究调查员报告的GI AE发生率的支持(Vumerity 34.8%,Tecfidera 49.0%)。总的AE发生率,Vumerity治疗组为78.3%,Tecfidera治疗组为83.7%。大多数AE的严重程度为轻度或中度。因AE导致研究停止的患者比例,Vumerity治疗组为1.6%,Tecfidera治疗组为6%。
原文出处:CHMP Recommends VUMERITY® (diroximel fumarate) for Approval in the European Union as a Treatment for Relapsing-Remitting Multiple Sclerosis
版权声明:本网站所有注明“来源:罕见病信息网”的文字、图片和音视频资料,版权均属于罕见病信息网网站所有。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。