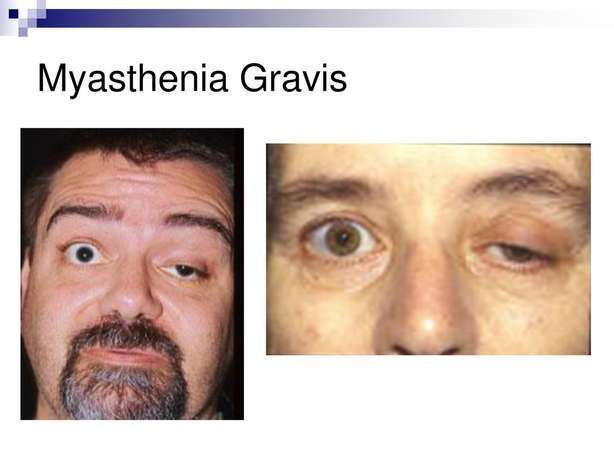
重症肌无力(图片来源:10faq.com)
再鼎医药合作伙伴argenx近日宣布,日本厚生劳动省(MHLW)已批准Vyvgart(efgartigimod alfa),该药是一种新生儿Fc受体(FcRn)拮抗剂,用于治疗对类固醇或非类固醇免疫抑制疗法(IST)应答不足的全身型重症肌无力(gMG)成人患者。
2021年12月,Vyvgart获得美国FDA批准,用于治疗抗乙酰胆碱受体抗体阳性(AChR Ab+)gMG成人患者。目前,efgartigimod也正在接受欧盟监管机构的审查,预计将在2022年下半年获得结果。
值得一提的是,Vyvgart是第一个也是唯一一个获监管批准的FcRn拮抗剂,将为gMG患者带来一种首创的靶向疗法。来自关键3期ADAPT试验的结果显示,Vyvgart治疗可显著改善gMG患者的力量和生活质量。特别是,大多数接受Vyvgart治疗的患者,在给药的头2周就观察到有临床意义的改善。这些结果对MG社区具有重要意义。
重症肌无力(MG)是一种由致病性IgG介导、严重影响生活质量的神经肌肉疾病,疾病症状以及当前疗法的副作用都可能对患者的生命造成重大损害。MG会对患者的生活和独立性产生毁灭性的影响,可能会影响吞咽、说话、行走甚至呼吸的能力。此外,每个患者经历MG的过程都不同,这会使疾病管理变得不可预测。
此次批准,基于关键3期ADAPT试验的结果。相关数据已于2021年6月发表于《柳叶刀-神经病学》(The Lancet Neurology)。文章标题为:Safety, efficacy, and tolerability of efgartigimod in patients with generalised myasthenia gravis (ADAPT): a multicentre, randomised, placebo-controlled, phase 3 trial。
结果显示,ADAPT试验达到了主要终点:在AChR Ab+gMG成人患者中,根据重症肌无力日常生活活动(MG-ADL)评分,在第一个治疗周期,与安慰剂组相比,efgartigimod治疗组有更高比例的患者为应答者(67.7% vs 29.7%;p<0.0001)。应答者被定义为在MG-ADL评分上连续4周或更长时间至少有2分的改善。此外,efgartigimod治疗组有40%的患者实现了最小症状表达(定义为MG-ADL评分为0[无症状]或1),而安慰剂组实现这一目标的患者比例仅为11.1%。在AChR-Ab+应答者中,84.1%的患者在治疗的头2周内MG-ADL评分有临床意义的改善。
此外,根据定量重症肌无力(QMG)量表评分,与安慰剂组相比,Vyvgart治疗组有更高比例的患者为应答者(63% vs 14%;p<0.0001)。应答者被定义为在第一个治疗周期内,QMG量表评分至少连续4周或更长时间下降3分。
该研究中,efgartigimod的安全性与安慰剂相当,最常见的不良事件是呼吸道感染(33% vs 29%[安慰剂])、头痛(32% vs 29%[安慰剂])、尿路感染(10% vs 5%[安慰剂])。
完成ADAPT试验后,90%的患者进入ADAPT plus试验,这是一项持续3年的开放标签扩展研究,旨在评估efgartigmod的长期安全性和耐受性。在ADAPT和ADAPT plus中,至少有118例患者接受了12个月或更长时间的efgartigmod治疗。
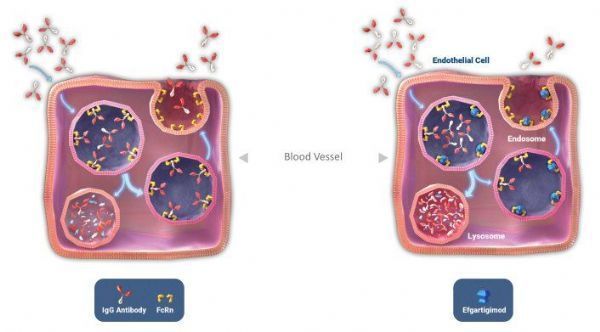
efgartigimod作用机制
Vyvgart的活性药物成分为efgartigimod,这是一款抗体片段,旨在减少致病性免疫球蛋白G(IgG)抗体并阻断IgG循环。efgartigimod可与FcRn结合,FcRn在全身中都有广泛表达,在阻止IgG抗体的降解过程中起着核心作用。阻断FcRn可降低IgG抗体表达水平,可治疗已知由致病IgG抗体驱动导致的自身免疫性疾病,包括:重症肌无力(MG),一种导致肌肉无力的慢性病;寻常性天疱疮(PV),一种以皮肤严重起泡为特征的慢性皮肤疾病;免疫性血小板减少症(ITP),一种表现为瘀斑和出血的慢性疾病;慢性炎症性脱髓鞘性多发性神经病(CIDP),一种神经系统受损导致运动障碍的疾病。
2021年1月6日,再鼎医药与argenx达成独家授权合作,再鼎医药将负责推进efgartigimod在大中华区(包括中国内地、香港、台湾和澳门地区)的开发和商业化工作。
再鼎医药自身免疫及抗感染领域首席医学官任海睿博士此前表示:中国目前有大约20万名重症肌无力患者,现有治疗方案非常有限,存在巨大的未满足临床需求。基于efgartigimod的现有数据,这一产品在获批后将有望改变全身型重症肌无力及其他严重的自身免疫类疾病的治疗现状。
根据协议条款,再鼎医药将获得在大中华区独家开发和商业化efgartigimod的权利。再鼎医药将负责efgartigimod多个适应症在中国的全球注册临床研究开发工作。此外,再鼎医药也将在大中华区负责启动多个新适应症的2期验证性研究,以在全球范围内加速开发efgartigimod的更多自身免疫类适应症。
原文出处:argenx Announces VYVGART™ Approval in Japan for the Treatment of Generalized Myasthenia Gravis
版权声明:本网站所有注明“来源:罕见病信息网”的文字、图片和音视频资料,版权均属于罕见病信息网网站所有。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。