2月4日,UCB宣布,zilucoplan在治疗成人全身性重症肌无力(gMG)的III期RAISE (NCT04115293) 研究中获得积极关键结果,并计划今年晚些时候递交监管申请。zilucoplan是一款在研、患者可自行给药的皮下注射(SC)新型环肽类C5补体抑制剂。

gMG是一种罕见的、使人衰弱的慢性自身免疫性神经肌肉疾病,可导致肌肉功能丧失和严重虚弱。据估计,美国、欧盟、日本确诊的gMG病例有近20万人。补体激活是抗体功能的关键介质,被认为是gMG病理学的重要驱动因素。
Zilucoplan靶向并高亲和力和特异性结合于补体末端激活途径的一个组分C5,从而阻止C5被C5转换酶裂解为补体成分C5a和C5b。此外,zilucoplan可以与C5b对应的C5结构域结合,从而阻断C5b与C6互补结合。zilucoplan的双重作用机制可阻止末端补体途径的激活以及膜攻击复合物(MAC)的下游组装和活性,从而阻止其损坏突触后膜,破坏离子通道传导和损害神经肌肉信号传递。
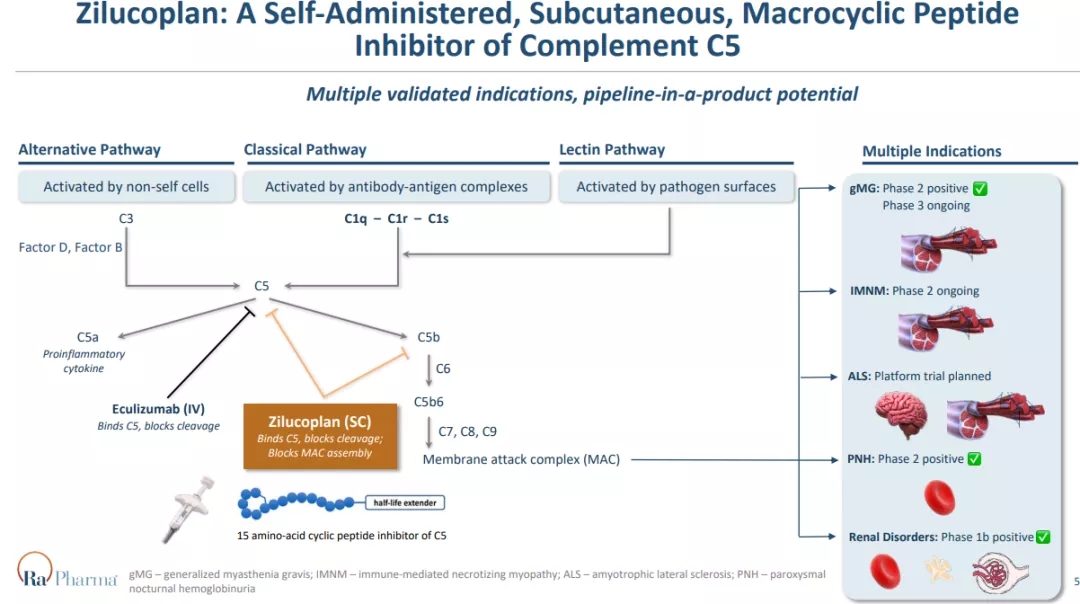
该研究达到主要终点,与安慰剂相比,第12周时zilucoplan组患者重症肌无力-日常生活活动能力量表(MG-ADL)总评分较基线有临床意义和统计学显著改善。研究也达到所有次要终点,与安慰剂组相比,第12周时,zilucoplan组的重症肌无力定量评分(QMG)、重症肌无力复合评分(MGC)和改良的15项重症肌无力生活质量(MG-QoL15r)评分较基线均有显著改善。
zilucoplan具有良好的耐受性,与早期的zilucoplan研究相比,无重大意外安全发现。zilucoplan和安慰剂组治疗期间出现的不良事件(TEAE) 的发生率相似。
近几年,治疗gMG的新药不断涌现,依库珠单抗(eculizumab)是Alexion(被阿斯利康收购)开发的针对补体C5的重组人源化单抗,于2017年获批治疗gMG,是FDA近60年来批准的第一个治疗gMG的新药。2021年12月17日,Argenx公司抗FcRn单抗Efgartigimod获批治疗gMG,是FDA批准的首个抗FcRn单抗,再鼎拥有大中华区权益。2021年12月21日,Alexion长效补体C5抑制剂Ultomiris (ravulizumab)的sBLA已获FDA受理并被授予优先审评资格。此外,赛诺菲已将BTK抑制剂tolebrutinib治疗gMG推至III期临床阶段。
版权声明:本网站所有注明“来源:罕见病信息网”的文字、图片和音视频资料,版权均属于罕见病信息网网站所有。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。