1 月 10 日,CDE 官网显示,北海康成罕见病用药「马昔巴特口服液」申报上市,拟纳入优先审评,用于 1 岁及以上 Alagille 综合征(阿拉杰里综合征,ALGS)患者胆汁淤积性瘙痒。

来自:CDE 官网
马昔巴特由 Mirum 公司开发,通过靶向纳依赖性胆汁酸转运蛋白(ASBT)使更多胆汁酸从粪便中排出,降低全身性胆汁酸水平,从而减少由此介导的肝脏损伤以及相关并发症。目前 Mirum 公司正在对其用于治疗多种胆汁淤积性肝病进行评估,包括 Alagille 综合症(ALGS)、进行性家族性肝内胆汁淤积(PFIC)和胆管闭锁(BA)。
Maralixibat 结构
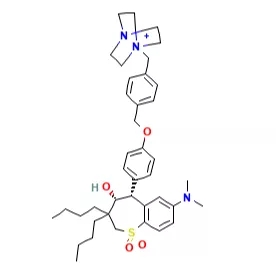
来自:CDE 官网
2021 年 9 月,美国 FDA 已通过优先审评途径批准 Maralixibat 上市,用于治疗 ALGS 患者的胆汁淤积瘙痒症,商品名为 LIVMARLI,这是美国获批的首个也是目前唯一一个用于这一罕见肝病的治疗药物。基于此,Mirum 公司获得了孤儿药、突破性疗法、罕有儿科疾病、优先审批资格认定,并获得了一张优先审评券。在欧洲,EMA 正在审评 Maralixibat 用于治疗 ALGS 儿童患者的上市申请。Mirum 已经启动其用于治疗胆管闭锁(BA)的全球 2b 期临床研究(EMBARK)。
LIVMARLI 的 FDA 批准是基于关键 IIb 期临床 ICONIC 研究以及来自支持性研究的五年数据,与安慰剂相比,服用 Maralixibat 的患者胆汁酸和瘙痒明显减少,黄体瘤减少以及长期性生长加速。在 86 名 ALGS 患者中,ALGS 典型症状瘙痒在统计学上显著减少,持续长达 4 年。而在一项 2 期 PFIC 研究中,遗传学确诊的 BSEP 缺陷的(PFIC2)患者对 Maralixibat 有应答反应,且其无移植存活率增加。在整个研究过程中,Maralixibat 的耐受性普遍良好。最常见的治疗相关不良反应为腹泻和腹痛。
在国内,2021 年 4 月,北海康成以 1100 万美元预付款 + 最高 1.09 亿美元里程碑付款 + 基于净销售额的双位数梯度特许权使用费获得了马昔巴特在大中华区的独家授权,开发 ALGS, PFIC 和 BA 适应症。
北海康成制药有限公司是一家创新生物制药公司,致力于在中国和全球加速推进罕见病和罕见肿瘤创新疗法的开发和商业化进程,以填补尚未满足的医疗需求。2021 年 12 月 10 日,北海康成在港交所上市。目前其管线中共有 11 款罕见病药物,涵盖罕见癌症、罕见病和基因疗法,其中引进自韩国 GC Pharma 的 Hunterase®(艾度硫酸酯酶β)已于 2020 年 9 月在中国获批。此外,北海康成还与药明生物建立了全球合作伙伴关系,共同开发和商业化治疗罕见遗传病的专利疗法。
ALGS 是一种罕见遗传性疾病,其表现为胆管异常狭窄、畸形和数量减少,导致胆汁积聚在肝脏内,最终导致进行性肝病。据估计,ALGS 的发病率为三万分之一。在 ALGS 患者中,多个器官系统可能受到基因突变的影响,包括肝脏、心脏、肾脏和中枢神经系统。
胆汁酸的积累使肝脏无法正常工作,无法清除血液中的废物。根据最近的报告,60%~75% 的 Alagille 综合征患者在成年之前都进行了肝脏移植。ALGS 肝损伤引起的体征和症状包括黄疸(皮肤发黄),xanthomas(皮肤下沉积的有损外形的胆固醇)和瘙痒。ALGS 患者所经历的瘙痒是任何慢性肝病中最严重的,并且最受影响的儿童在 3 岁之前就会出现症状。
目前针对 Alagille 综合征患者胆汁淤积性瘙痒,国内尚无药物获批,在美国也仅有马昔巴特一款产品获批。通过针对儿科罕见疾病的优先审评通道,马昔巴特有望在国内加快审评审批,为相应患者提供肝脏移植之外的治疗方案。
版权声明:本网站所有注明“来源:罕见病信息网”的文字、图片和音视频资料,版权均属于罕见病信息网网站所有。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。