近日,基因组医学公司Sangamo Therapeutics公布了AAV基因疗法Isaralgagene civaparvovec(ST-920)的一项1/2期STAAR临床研究的最新数据,这是对ST-920正在进行的首次人体临床研究。ST-920是一种重组AAV2/6载体,编码人类a-Gal A的cDNA,该研究旨在评估ST-920递增剂量治疗法布里病的安全性和耐受性。

法布里病是一种由GLA突变引起的罕见X连锁遗传性溶酶体贮积症,大多数患者目前的护理标准是静脉注射(IV)酶替代疗法(ERT),但是每隔一周的终身输液给患者和家庭带来了巨大的负担。而Isaralgagene civaparvovec只需进行一次性输注,无需预处理,旨在为法布里病患者提供稳定、长期的α-Gal A活性水平。重要的是,α-Gal A的持续产生能够减少和潜在清除法布里病底物Gb3和lyso-Gb3。Isaralgagene civaparvovec已经获得了美国食品和药物管理局(FDA)和欧洲药品管理局授予的孤儿药称号。
STAAR研究中,研究人员对5名患有典型法布里病的男性进行了给药,患者的年龄范围为22至48岁。数据显示,Isaralgagene civaparvovec在三个剂量队列中普遍耐受性良好,没有出现严重或高于1级的治疗相关不良事件(AE),也没有出现需要类固醇治疗的肝酶升高。
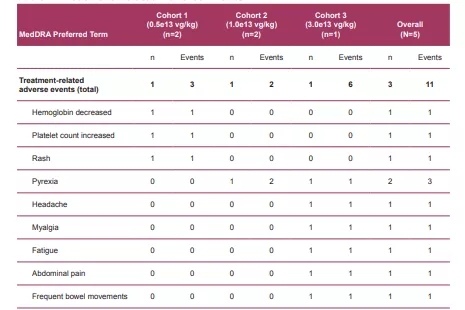
▲ 图片来源:参考资料1
在前两个剂量队列(0.5e13 vg/kg 和 1e13 vg/kg)中,接受治疗的4名患者的α-Gal A活性均高于正常水平3倍至15倍;第一剂量队列中的患者α-Gal A活性升高已持续一年,目前正在进行长期随访研究;在第三个剂量队列(3e13 vg/kg)中,第一位患者的α-Gal A活性在第2周表现出平均正常水平,第二位患者最近在截止日期之后进行了给药。
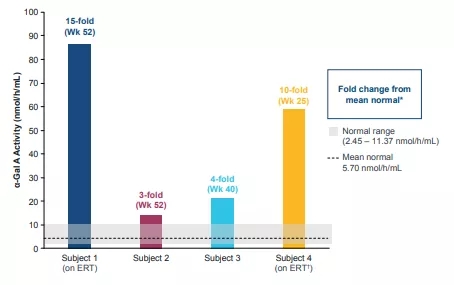
▲ 图片来源:参考资料1
前三名接受治疗的患者出汗能力有所改善。
在治疗前患有心肌病的两名患者中未观察到法布里心肌病的进展;一名预处理患者在用Isaralgagene civaparvovec治疗后,生物标志物lyso-Gb3显著降低约40%。Lyso-Gb3基线水平较低的患者在截止日期前仍保持稳定水平。
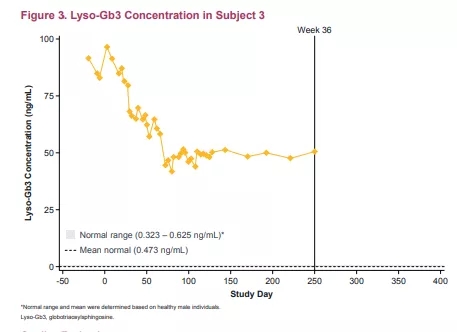
▲ 图片来源:参考资料1
Jaya Ganesh医学博士表示:”这些数据证明了ST-920基因疗法具有解决法布里病最具挑战性症状的潜力,具有良好的耐受性和安全性。”
Sangamo开发主管Rob Schott表示:“我们对1/2期STAAR研究的最新数据感到非常满意,并相信这一基因疗法有可能成为法布里病患者的可靠治疗选择。我们的重点是完成1/2期研究并为3期做准备。”
Sangamo Therapeutics
Sangamo Therapeutics拥有强大的基因组药物产品线,利用突破性的科学,包括专有的锌指(ZF)平台和制造专业知识,旨在为患有现有治疗方案不足或目前不存在的疾病的患者创造新的基因组药物,用明天的基因组疗法取代今天的对症治疗。
ZF平台由可以精确结合任何DNA序列的DNA结合结构域组成,并根据治疗需要与各种功能域(如核酸酶和转录因子)结合。由于其紧凑的尺寸,ZF技术具有高度的矢量兼容性。将ZF技术与递送载体相结合,可以创建基于ZF的基因组药物。
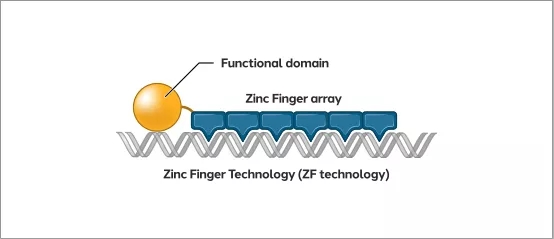
▲ 图片来源:Sangamo Therapeutics官网
Sangamo的ZF平台可用于为体外细胞治疗和体内基因组工程创建基因组药物。
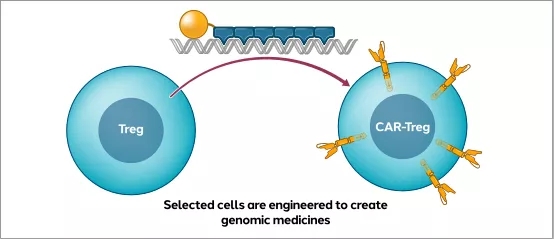
▲体外细胞治疗—利用ZF技术生产的CAR-Tregs治疗免疫介导的疾病
( 图片来源:Sangamo Therapeutics官网)
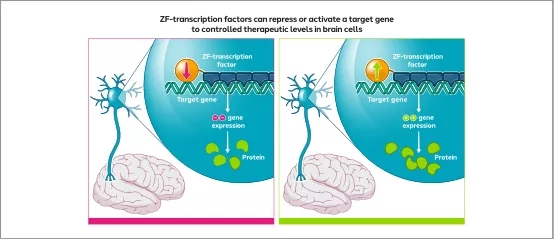
▲体内基因组工程—使用与转录因子结构域偶联的锌指来创建可以调节神经系统疾病中基因表达的基因组药物( 图片来源:Sangamo Therapeutics官网)
AAV与罕见病
目前,全球已知的罕见病超过7000种,约占人类疾病的10%。在种类繁多的罕见病当中,约有80%是由于基因缺陷所导致的,具有遗传性。世界卫生组织(WHO)将罕见病定义为患病人数占总人口数0.65‰~1‰的疾病。而我国因人口基数庞大,所以罕见病患者的人数并不罕见。
近年来,基因治疗为治疗常见和罕见遗传性疾病带来了新希望,在基因治疗这场竞技赛中,AAV载体已经迅速成为体内基因导入主要平台之一,在多个疾病治疗临床试验中显现出有明显的治疗效果,而且不会引起显著的不良免疫反应。
AAV是一种非致病性病毒,已在临床背景下进行了广泛研究。与其他病毒载体相比,AAV已被证明具有较低的免疫原性。除此之外,基于AAV的基因疗法也有望在单次给药后实现持久甚至终生的临床获益,也称为“一次性治疗”。AAV较适用于直接向靶组织进行给药,即直接注射到相关病灶部位或理想的生物活性部位。
迄今为止,已有两种AAV基因疗法被FDA批准。第一种为Luxturna,于2017年获得批准用于治疗RPE65基因突变引起的遗传性视网膜疾病(Inherited retinal disease,IRD),这一里程碑事件为基因治疗在主流医疗实践中争取到了一席之地;第二种为Zolgensma,于2019年获得批准用于治疗小儿脊髓性肌萎缩症。除了以上这两种获得批准的治疗方法外,其他几种AAV疗法已经或者正在世界范围内开展临床试验进行评估,多个公司更是重金布局AAV基因疗法来治疗罕见病。
2021年3月1日,专注于开发心脏疾病疗法的生物技术公司Tenaya Therapeutics宣布完成1.06亿美元的C轮融资,该轮融资将用于将其治疗肥厚型心肌病(HCM)的AAV基因疗法推进临床,并在旧金山湾区建立用于AAV生产的专有cGMP工厂等。
2021年7月14日,基因治疗领域新锐Kriya Therapeutics宣布完成1亿美元B轮融资,融资所得将用于进一步增强Kriya在制造技术、AAV载体设计和开发上的能力;扩大其治疗管线,并推进现有管线中针对代谢性疾病、眼部疾病和肿瘤疾病适应症的多个AAV基因治疗项目。
2022年1月,GenSight Biologics报告了其AAV基因疗法LUMEVOQ治疗Leber遗传性视神经病变(LHON)的长期临床数据。研究显示,受试者在单次注射基因治疗4年后,视力依然持续得到显著改善。
2022年1月,BioMarin公布了其基于AAV5载体的基因疗法valrox治疗A型血友病的3期临床研究GENEr8-1的完整数据,134名受试者在两年分析中达到了所有主要和次要疗效终点。数据显示,年化出血率(ABR)较基线降低了85%,且累积平均年化出血率(ABR)均低于1。
2022年2月,Astellas宣布其AAV基因替代疗法AT845在1/2期临床试验中的积极中期数据,该药物可提供功能性α-葡萄糖苷酶(GAA)基因,用于治疗迟发性庞贝病(LOPD)。目前庞贝病唯一获批的治疗方法是ERT,仍然存在大量未满足的医疗需求,这主要是由于ERT无法穿透受疾病影响的关键组织以及ERT的免疫原性。AT845通过靶向肌肉组织来解决ERT的局限性。同时,利用相对低剂量的8型腺病毒载体进行靶向基因传递治疗,有益于增加对GAA的免疫豁免。
基因治疗给罕见病患者带来了更多也或许是更好的治疗选择。总之,罕见病治疗领域近年来取得了喜人的发展,医药企业的研发热情显著提高。但我们也需要意识到,罕见病的数目庞大,还有大量的空白需要去创新、去突破。期待随着AAV研发领域的不断拓展,研究人员们能够克服该领域目前面临的各项挑战,释放AAV基因疗法的全部潜力,给罕见病患者带来新希望。
参考资料:
1.https://investor.sangamo.com/static-files/5aa6f2e3-e384-4bb1-b33a-f4b505fd2ae9
2.https://www.biospace.com/article/releases/sangamo-therapeutics-announces-updated-preliminary-phase-1-2-data-showing-tolerability-and-sustained-elevated-%ce%b1-gal-a-enzyme-activity-in-patients-with-fabry-disease/