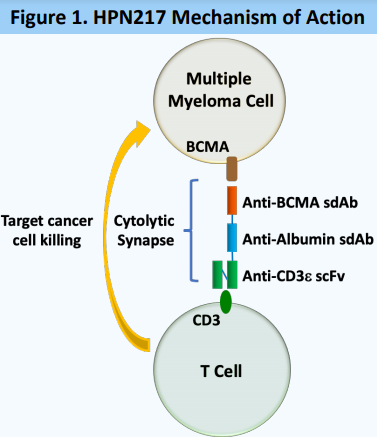
HPN217作用机制
Harpoon Therapeutics是一家临床阶段的免疫治疗公司,致力于开发一类新型T细胞接合器,利用人体免疫系统的力量治疗癌症和其他疾病。近日,该公司宣布,美国食品和药物管理局(FDA)已授予HPN217快速通道资格(FTD):这是一款靶向B细胞成熟抗原(BCMA)的TriTAC,用于治疗既往至少接受过4种治疗的复发或难治性多发性骨髓瘤(RRMM)患者。目前,评估HPN217治疗RRMM患者的一项1/2期临床试验正在进行中。
T细胞接合器是一种工程化蛋白质,可引导患者自身的T细胞杀死表达特定蛋白质或抗原的靶细胞。Harpoon利用其专有的三特异性T细胞激活结构(TriTAC®)平台,正在开发一系列新型TriTAC,最初专注于实体瘤和血液系统恶性肿瘤的治疗。
2019年11月,Harpoon Therapeutics与AbbVie达成了一项许可和选择权协议,以推进HPN217并扩大现有的发现合作。根据协议条款,艾伯维可在完成1/2期临床试验后行使其许可HPN217的选择权。
Harpoon Therapeutics总裁兼首席执行官Julie Eastland表示:“我们很高兴HPN217获得了美国FDA授予快速通道资格认定,这突显了既往接受过多种疗法的复发或难治性多发性骨髓瘤患者中显著未满足的医疗需求。HPN217有潜力为这些患者提供一种创新的治疗选择。”
原文出处:Harpoon Therapeutics Receives FDA Fast Track Designation for HPN217