自2017年8月(Kymriah)tisagenlecleucel在美国首次批准用于治疗急性淋巴细胞白血病以来,目前至少已有8个基因疗法获美国FDA批准上市,其中包括最近批准的Carvykti(ciltacabtagene autoleucel),详见下表。
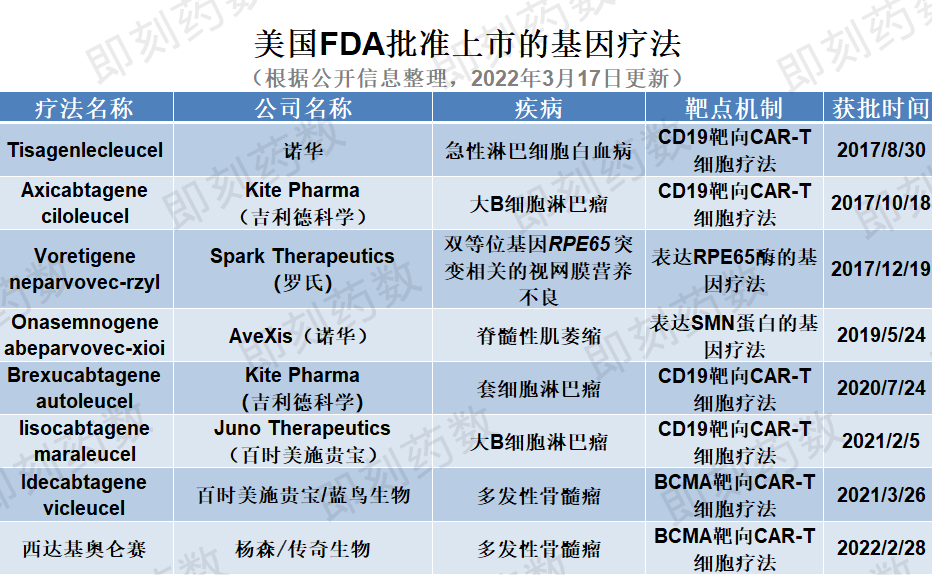
(药明康德内容团队制图,点击可见大图,括号中公司收购了产品的研发公司)
在刚刚过去的2月份,已有杨森(Janssen)和传奇生物联合开发的Carvykti获得FDA批准,今年还有3种基因疗法可能获得FDA批准,另外8种预计在年底前提交生物制品许可申请(BLA)。
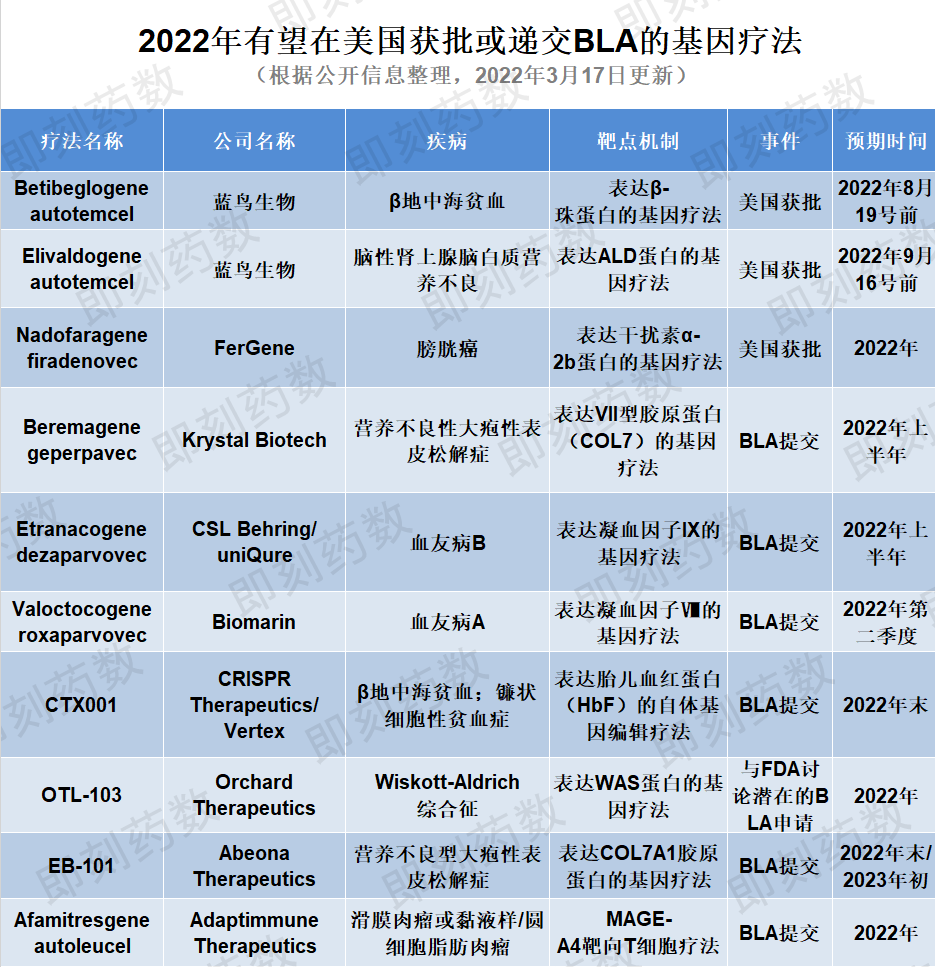
(药明康德内容团队制图,点击可见大图)
1. 疗法名称:Betibeglogene autotemcel
公司名称:蓝鸟生物
适应症:β地中海贫血

2022年蓝鸟生物公司有两种基因疗法预计将获得FDA批准。Betibeglogene autotemcel(beti-cel)是一种造血干细胞体外基因疗法,用于治疗需要接受常规血红细胞输注的β地中海贫血患者。该疗法从患者体内分离出造血干细胞,并利用病毒载体引入经过修饰、能行使正常功能的β球蛋白基因,是一种潜在的一次性治疗基因疗法。目前该BLA申请正在接受FDA审评,PDUFA目标日期设定为2022年8月19日。蓝鸟生物预计FDA外部专家委员会将在2022年6月召开会议讨论这一申请。目前该疗法已获FDA优先审评资格,如果获得FDA的批准,预计该疗法会成为潜在的美国首个针对β地中海贫血患者的慢病毒载体基因疗法。
2. 疗法名称:Elivaldogene autotemcel
公司:蓝鸟生物
适应症:脑肾上腺脑白质营养不良

FDA正在审评的蓝鸟生物的第二种基因疗法是elivaldogene autotemcel(eli-cel),治疗18岁以下携带ABCD1基因突变的早期脑性肾上腺脑白质营养不良患者(CALD)。这种疾病是由于ABCD1基因突变引起的,这种突变影响了ALD蛋白的产生,随后导致极长链脂肪酸(VLCFAs)的毒性积累,主要发生在肾上腺、大脑与脊髓的白质中。FDA正在审评该BLA申请,PDUFA目标日期为2022年9月16日。与beti-cel一样,蓝鸟生物预计FDA外部专家委员会将在2022年6月召开会议。
3. 疗法名称:Nadofaragene firadenovec
公司名称:FerGene(Ferring)
适应症:膀胱癌

2022年FDA正在审查的基因疗法还包括nadofaragene firadenovec(Instiladrin),由Ferring Pharmaceuticals的子公司FerGene开发,用于治疗对卡介苗(BCG)响应不佳的晚期高级非肌层浸润性膀胱癌(high grade NMIBC)。Nadofaragene firadenovec最初由芬兰基因疗法公司FKD Therapies开发,Ferring在2018年与FKD Therapies达成合作共同开发这一基因疗法,并且将这一资产转给了FerGene公司。这种全新的基因疗法机制可以将患者自身膀胱壁细胞转化为制造多种干扰素的微型工厂,增强机体抵抗癌症的天然防御能力。2019年,积极的3期结果显示该疗法已达到其主要疗效终点,并且具有良好的安全性和耐受性。此前FDA曾授予其快速通道资格,突破性疗法认定和优先审评资格,并接收递交的BLA。如果2022年获得批准,该疗法将为对BCG无反应的NMIBC患者提供一个有希望的选择。
4. 疗法名称:Beremagene geperpavec
公司:Krystal Biotech
适应症:营养不良性大疱性表皮松解症

对于即将在美国提交BLA的基因治疗候选药物,第一个介绍的是Krystal Biotech的beremagene geperpavec,一种表达VII型胶原蛋白(COL7)的局部基因疗法,用于治疗营养不良性大疱性表皮松解症(DEB),这是一种罕见且严重的疾病,影响皮肤和黏膜组织。该疗法旨在通过为患者的皮肤细胞提供制造正常COL7蛋白的模板,在分子水平上治疗DEB。继2021年11月公布的积极安全性和有效性3期结果后,该公司有望在2022年上半年向美国FDA提交BLA。
5. 疗法名称:Etranacogene dezaparvovec
公司:uniQure、CSL Behring
适应症:血友病B

Etranacogene dezaparvovec由uniQure与CSL Behring合作开发,旨在使用腺相关病毒5(AAV5)载体递送表达FIX Padua变体的基因,用于治疗中重度至重度血友病B。已在其3期试验中证明了安全性并达到了主要和次要疗效终点。CSL计划在2022年上半年在美国和欧盟提交该疗法的上市申请。如果获得批准,etranacogene dezaparvovec可能是潜在的第一个为血友病B患者提供持久、功能性治疗益处的基因疗法。
6. 疗法名称:Valoctocogene roxaparvovec
公司名称:BioMarin Pharmaceutical
适应症:血友病A

BioMarin的基因疗法候选药物valoctocogene roxaparvovec也是一种基于AAV5的基因疗法,准备在今年提交BLA。该疗法用AAV5病毒载体递送表达凝血因子VIII的转基因,用于治疗血友病A,这是一种遗传性罕见的出血性疾病。BioMarin最初于2019年12月向FDA提交了BLA,FDA要求提供进一步的后续数据。2022年1月,公司公布了其全球性3期临床试验的两年随访安全性和有效性数据,显示主要和次要终点均已达到。BioMarin计划于2022年第二季度在美国重新提交其BLA,用于治疗严重的血友病A,预计最早获批时间为2022年底。
7. 疗法名称:Eladocagene exuparvovec
公司:PTC Therapeutics
适应症:芳香族 L-氨基酸脱羧酶缺乏症

PTC Therapeutics的eladocagene exuparvovec(PTC-AADC)是一种基因替代疗法,单剂量将人类多巴脱羧酶(DDC)基因递送到大脑的壳核中,用于治疗芳香族L-氨基酸脱羧酶缺乏症(AADCD),一种影响大脑的罕见遗传疾病。来自三个1期和2期临床试验的5年结果分析表明,AADCD儿童的运动功能和认知能力持续得到改善。公司计划在2022年第二季度提交BLA。如果获得批准,这将是AADCD患者潜在的第一个上市治疗方式。目前,根据公开领域信息,在该疾病领域尚未有其他基因疗法处于后期临床试验中。
8. 疗法名称:Afamitresgene autoleucel
公司:Adaptimmune Therapeutics
适应症:膜肉瘤或黏液样/圆细胞脂肪肉瘤(MRCLS)

Afamitresgene autoleucel(afami-cel)是Adaptimmune Therapeutics公司的开发的工程化靶向MAGE-A4抗原的T细胞疗法。该疗法在其正在进行的滑膜肉瘤和粘液样/圆细胞脂肪肉瘤(MRCLS)2期研究中达到了主要疗效终点。基于积极的结果,Adaptimmune准备在2022年第四季度提交一份用于滑膜肉瘤的BLA申请。目前,手术是滑膜肉瘤的首选治疗方法,有些病人会在手术前后接受放射治疗。如果获得批准,afami-cel将为该患者群体提供具有更高生活质量的替代治疗。
9. 疗法名称:CTX001
公司名称:CRISPR Therapeutics、Vertex Pharmaceuticals
适应症:β地中海贫血;镰刀型细胞贫血病

CTX001是一种非病毒载体的基因编辑疗法,由CRISPR Therapeutics和Vertex合作开发,用于治疗患有输血依赖性β地中海贫血(TDT)或严重镰刀型细胞贫血病(SCD)的患者,通过在体外对患者的造血干细胞进行改造,使红细胞中产生高水平的胎儿血红蛋白(HbF)。该疗法已完成其正在进行的3期研究的患者注册,并已对70多名患者进行了给药。CTX001已获得美国FDA授予治疗TDT和SCD的再生医学先进疗法(RMAT)认定、以及快速通道和孤儿药资格。Vertex计划在2022年底提交CTX001用于治疗这两种适应症的全球(包括美国FDA)监管申请文件。
10. 疗法名称:EB-101
公司:Abeona Therapeutics
适应症:隐性营养不良型大疱性表皮松解症

今年有望在美国递交上市申请的另外一种COL7A1基因靶向疗法是Abeona的EB-101。该疗法是一种体外基因校正的自体细胞疗法,将COL7A1胶原蛋白基因插入到患者自身的皮肤细胞(角质形成细胞)中。该疗法正在一项3期安全性和有效性临床试验中进行研究,用于治疗隐性营养不良型大疱性表皮松解症(RDEB),这是一种罕见的结缔组织疾病,目前还没有获得批准的疗法。在1/2期研究中,EB-101已显示出可观的伤口愈合和长达六年的长期疼痛减轻效果。Abeona已完成其3期试验的患者注册,并预计将在2022年第三季度提供一线结果,随后将在2022年底或2023年初提交BLA申请。
11. 疗法名称:OTL-103
公司名称:Orchard Therapeutics
适应症:Wiskott-Aldrich综合征

Orchard Therapeutics的OTL-103是一种自体造血干细胞基因疗法,包括用编码Wiskott-Aldrich综合征(WAS)基因的慢病毒载体体外转染的CD34+细胞,旨在通过单次注射治疗Wiskott-Aldrich综合征,这是一种罕见的遗传性免疫缺陷紊乱。该疗法已获得FDA授予的孤儿药资格和罕见儿科疾病(RPD)资格。目前,评估疗效和安全性的3期临床试验正在进行中,Orchard计划在2022年初与FDA讨论其潜在的BLA申请。