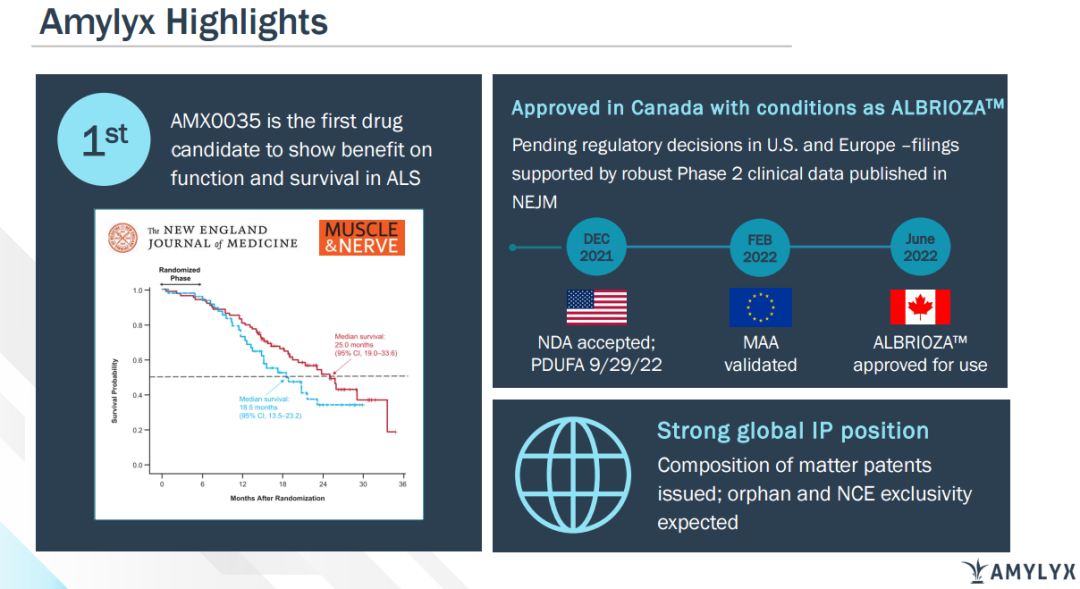
6月13日,Amylyx Pharmaceuticals宣布,加拿大卫生部已批准Albrioza(苯丁酸钠和牛磺酸二醇口服固定剂量配方)有条件上市,用于治疗肌萎缩性侧索硬化症(ALS)。Albrioza是首个在ALS中显示出功能和生存改善的药物。此次也是该产品在全球的首次批准。
根据有条件批准规定,Amylyx需要按计划递交正在进行的III期PHOENIX试验结果,Amylyx预计2024年获得关键数据。
ALS又被称作“渐冻人”症,是一种不断进展且致命的神经退行性疾病,由大脑和脊髓运动神经元死亡引起。ALS患者的运动神经元缺失导致肌肉功能恶化,患者无法移动、说话,呼吸麻痹,直至死亡。加拿大目前约有3000人患有ALS,从症状发作开始的平均寿命为2-5年,每年约有1000人死于ALS,每年的确诊人数相似。
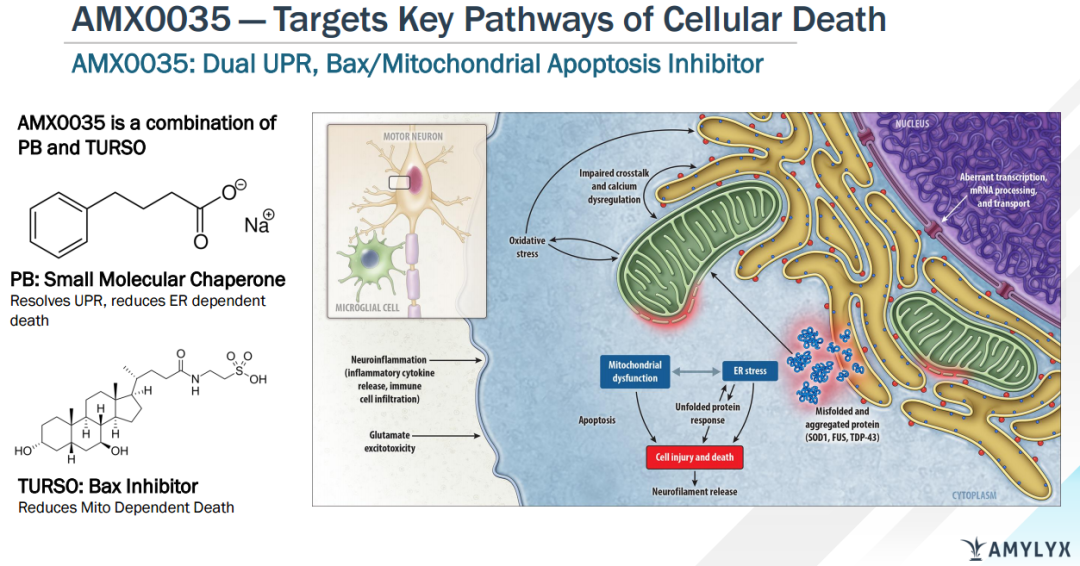
研究表明内质网和线粒体功能障碍是导致ALS神经元死亡的关键因素,在死后ALS脊髓样本中观察到UPR内质网凋亡蛋白和BAX线粒体凋亡蛋白上调。Albrioza(AMX0035)包含两种有效成分:苯丁酸钠(sodium phenylbutrate,PB)和牛磺酸二醇(taurursodiol,TURSO)。苯丁酸钠是一种小分子蛋白伴侣,可降低UPR,防止内质网依赖细胞死亡。牛磺酸二醇是一款Bax蛋白抑制剂,可防止线粒体依赖细胞死亡。
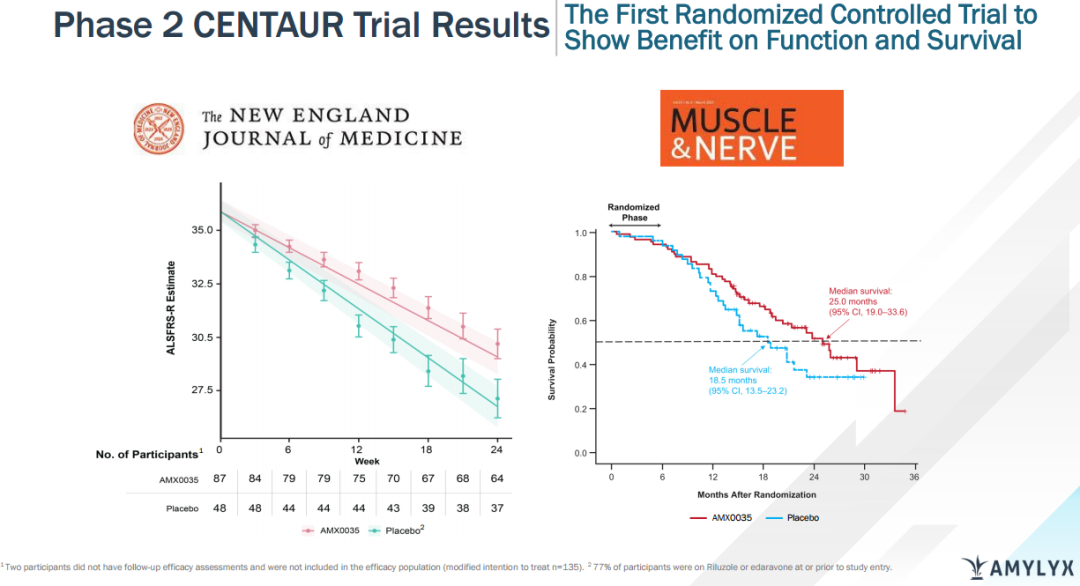
Albrioza的获批是基于一项在137例ALS受试者中开展的多中心II期临床试验(CENTAUR)数据,该研究包括6个月随机安慰剂对照期和开放性长期随访期。研究结果表明,接受Albrioza治疗的受试者ALS功能评定量表-修订版(ALSFRS-R)平均评分在24周内改善2.32分。此外,接受Albrioza治疗患者的中位生存时间也较安慰剂组延长了6.5个月。该项研究详细数据已发表在《新英格兰医学杂志》以及《神经病学、神经外科和精神病学杂志》上。
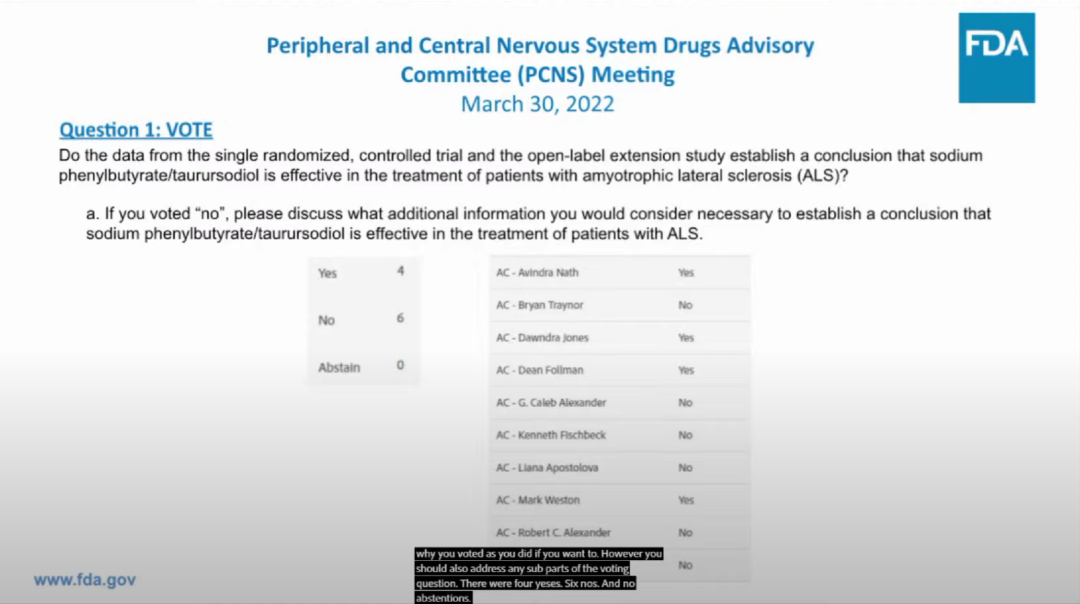
AMX0035目前正在接受FDA审查,今年3月30日,美国FDA召开了外周和中枢神经系统药物咨询委员会(PCNSDAC)会议,以审查AMX0035。原因是,虽然该药已经达到了证明其疗效的III期临床试验CENTAUR的主要终点。然而,咨询委员会成员认为,其p值为0.034的统计意义“不是很有说服力”。
最终专家组以6:4持反对意见,认为目前的研究结果不足以支持AMX0035的“有效性”结论。消息发布当天Amylyx股价应声下跌61%。
在PDUFA日期被推迟了3个月后,AMX0035将于9月29日迎来最终的审批决定。FDA是否会像批准渤健阿尔兹海默病新药一样不顾专家组反对意见批准这款临床需求未满足新药,我们将持续关注。