2022 年 6 月 7 日,Immatics和Editas Medicine共同宣布,两家公司已达成战略研究合作和许可协议,将 gamma-delta T 细胞过继细胞疗法和基因编辑相结合,以开发用于治疗癌症的药物。通过将Editas Medicine的基因编辑技术与Immatics的ACTallo,基于gamma-delta T细胞的过继细胞治疗平台相结合,gamma-delta T细胞可以被重定向到癌细胞的靶点,从而创造出具有增强肿瘤识别和破坏能力的细胞。根据协议条款,Editas Medicine 将有资格获得未披露的预付款以及基于开发、监管和商业里程碑的额外付款;Immatics 将就此次合作可能产生的产品支付特许权使用费。

Immatic创建于2000年,是一家活跃于发现和开发 T 细胞重定向癌症免疫疗法的生物技术公司,专注于免疫治疗药物的发现。公司的候选产品是一流的过继细胞疗法和双特异性TCR分子,这些产品的肿瘤靶点是由Immatics的领先的专利平台XPRESIDENT识别和验证,与Immatics强大的TCR发现技术XCEPTOR结合,开发的广泛而多样的癌症免疫治疗组合,包括以ACTolog(自体)、ACTengine(自体)和ACTallo(异体)方法为基础的T细胞治疗方案,以及若干双特异性TCR和抗体分子(TCER分子)。
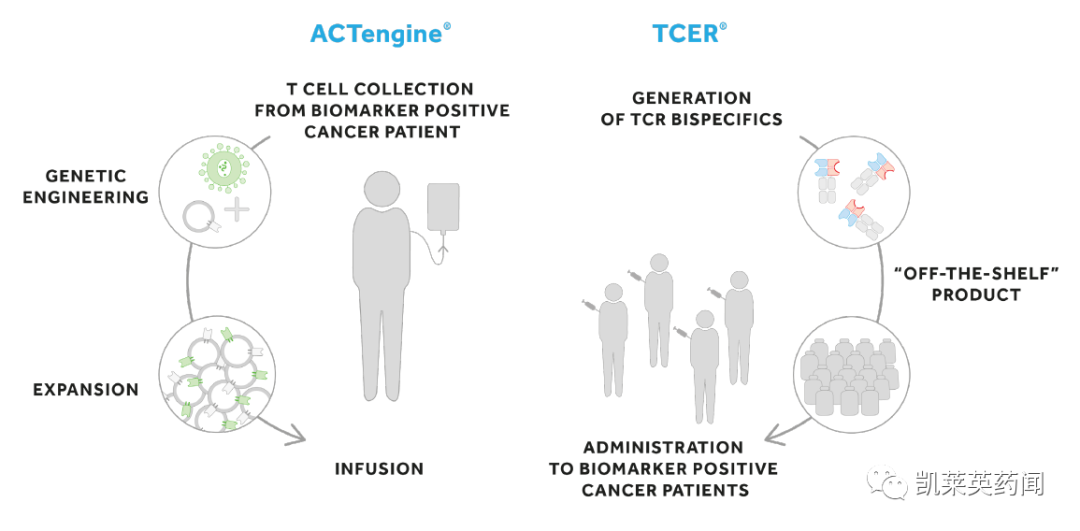
近年来,Immatics先后与Genmab、Amgen、Morphosys、Roche、Celgene以及MD Anderson癌症中心、BMS等多家合作伙伴联合开发过继细胞疗法和双特异性抗体,其中,与BMS合作的总价值达到 42 亿美元。

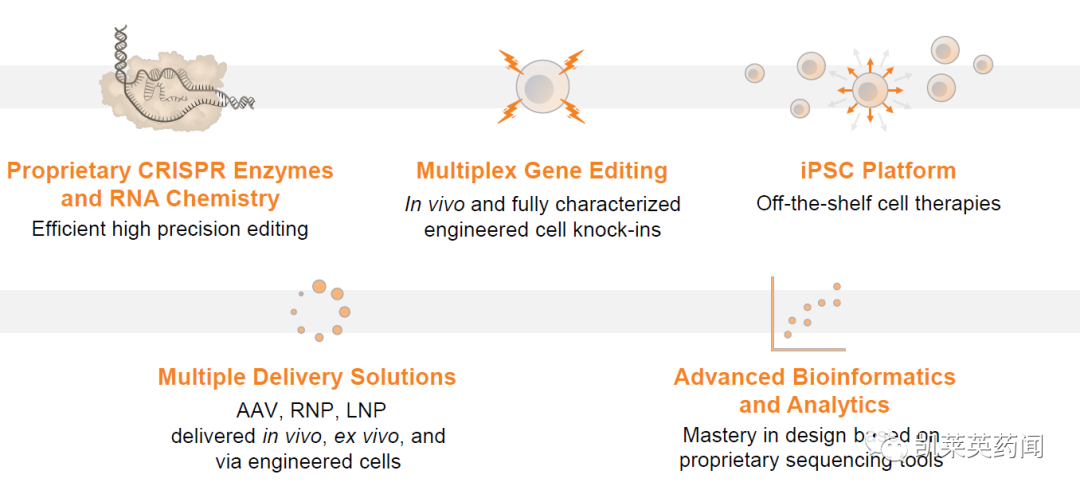
Editas Medicine是一家领先的基因组编辑公司,专注于将 CRISPR/Cas9 和 CRISPR/Cas12a 基因组编辑系统转化为针对世界各地患有严重疾病的人群的强大治疗管道。公司旨在发现、开发、制造和商业化针对各种疾病的变革性、耐用、精准的基因组药物。
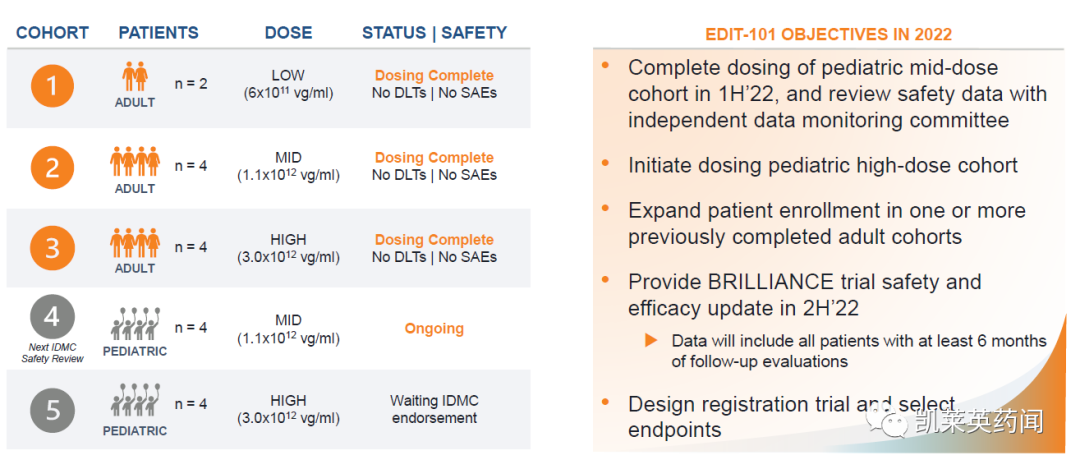
其中,代表药物EDIT-101通过视网膜下注射给药,以达到基因编辑机制并将其直接传递到感光细胞,正在开发用于治疗 Leber 先天性黑蒙 10 (LCA10),这是一种与 CEP290 相关的视网膜退行性疾病。目前,EDIT-101已获得FDA罕见儿科疾病和孤儿药称号以及EMA的孤儿药称号。
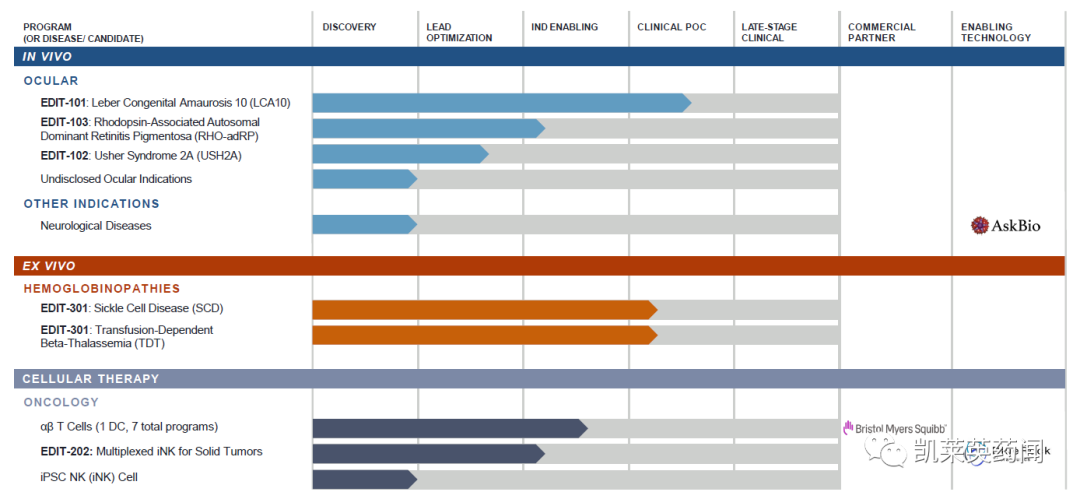
近日,该公司的另一款药物EDIT-301被FDA认定为孤儿药,用于治疗β地贫和镰状细胞病。

目前,公司基因编辑药物的管线如下:
CRISPR基因编辑技术自问世以来不但在基础研究领域,而且在临床开发方面也获得飞速的进展。期待细胞疗法与基因编辑能够碰撞出新的火花!