2021年6月26日,Intellia Therapeutics 在国际顶尖医学期刊《新英格兰医学杂志》(NEJM)发表了具有里程碑意义的临床试验论文。这是首个体内 CRISPR 基因编辑疗法的临床试验结果,大大扩展了 CRISPR 基因编辑疗法的应用范围,直接注射 CRISPR 组份即可在体内进行高效基因编辑,为许多遗传疾病的治疗开辟了新的途径,被誉为“开启了医学新时代”。
该疗法编号为 NTLA-2001,由 CRISPR 基因编辑技术奠基人、诺奖得主詹妮弗·杜德娜(Jennifer Doudna)创立的 Intellia Therapeutics 和再生元公司合作开发。用于治疗转甲状腺素蛋白淀粉样变性(ATTR),AATR 是一种危及生命的严重罕见遗传疾病,据估计,全球大约有5万名患者,该疾病的特征是错误折叠的转甲状腺素蛋白(TTR)蛋白神经和心脏等组织中积累。
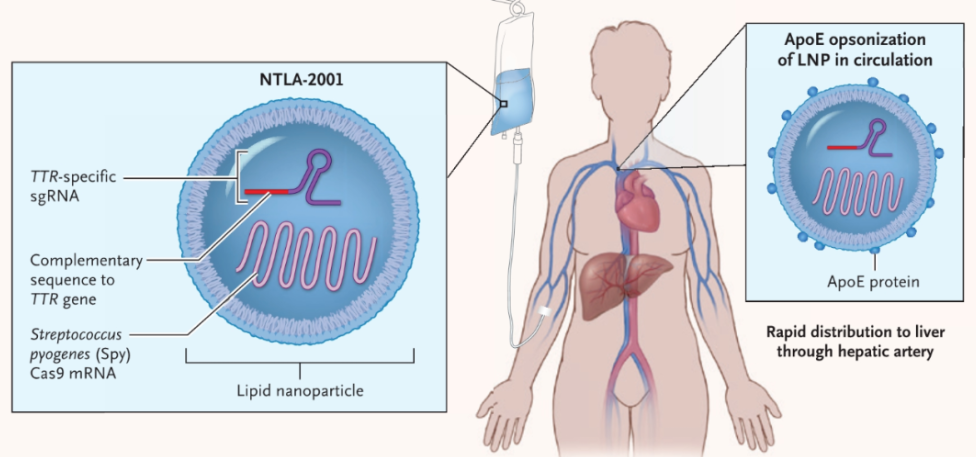
NTLA-2001 疗法,通过脂质纳米颗粒(LNP)载体,将携带靶向致病基因 TTR 基因的 sgRNA 和优化的 spCas9 蛋白的 mRNA 序列,递送至肝脏。
1期临床数据显示,在6名接受治疗的患者中(3名患者接受0.1mg/kg剂量,3例患者接受0.3mg/kg剂量)。接受治疗28天后,两种不同剂量的患者血清中 TTR 蛋白水平分别平均下降52%和87%,且未观察到严重不良反应。
2022年6月24日,Intellia 和再生元公布了 NTLA-2001 疗法的最新1期临床试验中期数据,效果积极,单次给药后患者血清中 TTR 蛋白水平的下降幅度在长达12个月时间里能够稳定持续。
主要结果如下:
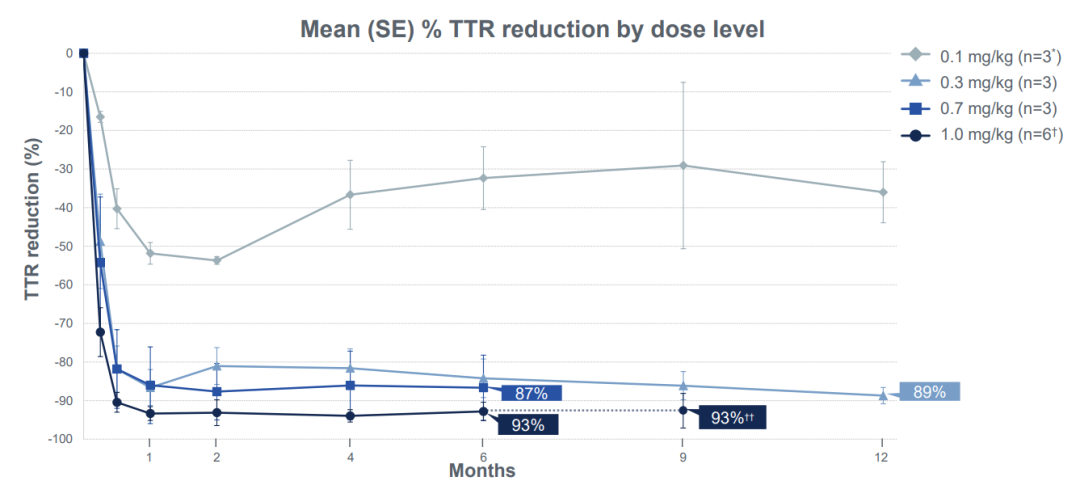
1、患者血清中 TTR 蛋白水平的降低在4组不同给药剂量组中均持续保持,低剂量组(0.1mg/kg和0.3mg/kg组)的随访时间达到了12个月,高剂量组(0.7mg/kg和1.0mg/kg组)的随访期达到了6个月。
2、1.0mg/kg剂量组,给药治疗后第28天血清 TTR 蛋白水平平均降低93%,最高降低98%,效果在随访的6-9个月时间里得以保持。
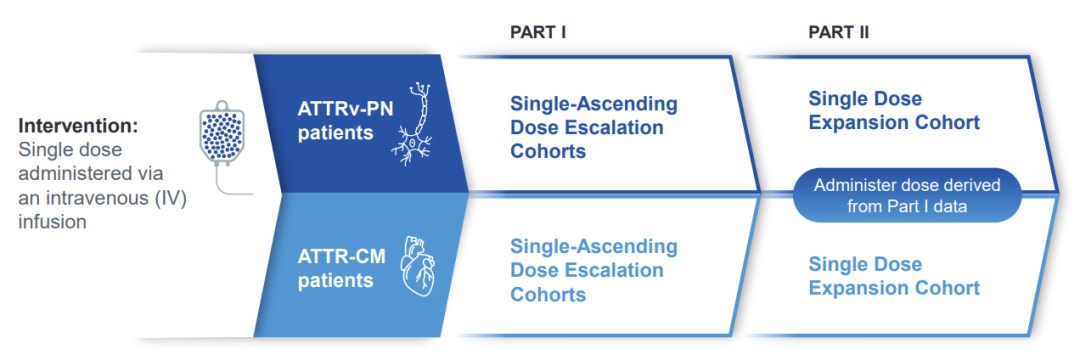
此次报告的是针对15名患有遗传性转甲状腺素蛋白淀粉样变性伴多发性神经病变(ATTRv-PN)的患者的扩展随访数据,这些患者在第一部分试验中分为四个剂量组:0.1mg/kg组(3人)、0.3mg/kg组(3人)、0.7mg/kg组(3人)、01.0mg/kg组(6人)。
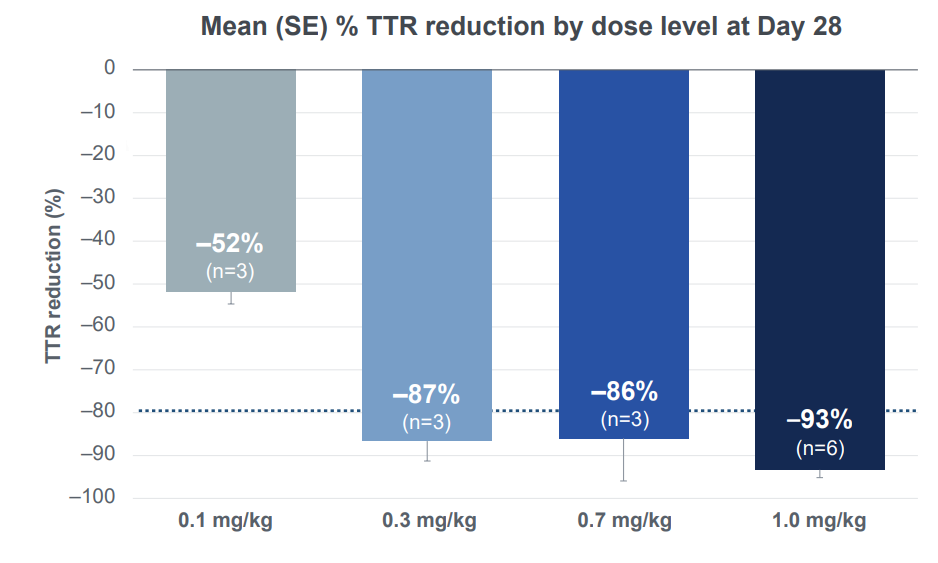
在最高剂量组(1.0mg/kg)中,6名接受治疗的患者在第28天平均血清 TTR 蛋白水平降低93%,最多降低98%。且在随访的6-9个月(3人随访时间达6个月,3人随访时间达9个月)中,这一降低水平得以保持,平均降低幅度为93%。
在0.7mg/kg剂量组中,第28天观察到的86%的平均血清 TTR 蛋白降低幅度也在随访的6个月里得以保持。
此外,在0.1mg/kg和0.3mg/kg组中,患者随访时间已达到12个月,血清 TTR 蛋白的降低幅度同样得以保持。值得注意的是,0.3mg/kg组的患者在12个月时平均血清 TTR 降低了89%。
在所有4个剂量组中,NTLA-2001 疗法在整个随访期间(中位随访时间为10个月)通常耐受性良好。大多数不良事件为轻微型,73%(n=11)的患者报告最大不良事件严重程度为1级。在1.0mg/kg剂量组中,有1名伴有胃轻瘫综合征病史的患者出现了严重呕吐的3级不良事件。最常见的不良事件包括头痛、输液相关反应、背痛、皮疹和恶心,且所有不良事件均在没有后遗症的情况下得以解决。
以上这些数据与药代动力学建模和模拟数据相结合,支持在第二部分试验中直接使用80mg的固定剂量,预计这一固定剂量将与1.0mg/kg剂量相似。目前80mg固定剂量的第二部分试验正在进行中。

Intellia 的总裁兼 CEO John Leonard 表示,此次公布的中期数据更清晰地显示了 NTLA-2001 疗法对 ATTR 淀粉样变性患者的治疗潜力。这些数据进一步强调了基因组药物的力量,并提高了 Intellia 更广泛的体内基因组编辑平台成功的可能性,也期待推进首个全身给药的体内 CRISPR 疗法的临床开发。
再生元的总裁兼 CSO George Yancopoulos 博士表示,这些数据强调了 NTLA-2001 的安全性和持久性,增强了其作为一次性、系统递送和持久的 CRISPR 疗法的信心。单剂量体内基因编辑有朝一日可以帮助患有各种难治性遗传疾病的患者,这是当今最令人兴奋的医学突破之一。
此外,Intellia 和再生元还将在今年下半年公布 NTLA-2001 治疗遗传性转甲状腺素蛋白淀粉样变性伴心肌病(ATTR-CM)的中期数据。