视神经脊髓炎谱系疾病(NMOSDs)是一组由抗水通道蛋白4-免疫球蛋白G(AQP4-IgG)介导的神经系统自身免疫病,利妥昔单抗治疗有效,但具体机制尚不明确。研究人员对63例NMOSDs患者的配对颈深淋巴结(dCLNs)和血液样本进行了分析,发现临床复发与AQP4-IgM的产生或AQP4-IgG亚类转移,即生发中心的活性有关,使用利妥昔单抗后,患者临床复发率、结内合成的AQP4-IgG及AQP4反应性B细胞水平均显著降低。这表明,生发中心活性是NMOSDs患者抗AQP4抗体生成的驱动因子,也是利妥昔单抗作用的主要靶点。

背景
AQP4-IgGs以IgG1亚类为主,通过特异性攻击富含AQP4的星形角质细胞而致NMOSDs发生。此病常易复发,逐渐累积致残。但临床发作的免疫生物学基础仍不清楚,同时缺乏可准确预测复发的生物学标志物。自身抗体有两种产生途径:1. 生发中心(GCs)中的抗原反应性B细胞在滤泡辅助性T细胞(Tfh)的帮助下,经过基因重排、体细胞高频突变等过程生成多样化的免疫球蛋白,持续的GCs活性可能是自身抗体(如AQP4-IgGs)长期存在的原因;2. 骨髓微环境中的长寿浆细胞(LLPCs)经历免疫事件后可存活数十年,分泌90%以上的血清IgG,其中包括各种自身抗体。迄今为止,一系列研究表明GC活性可能在AQP4-IgG的产生中发挥重要作用。 结果 一、AQP4-IgG亚类、AQP4-IgM的动态改变与复发有关
接受利妥昔单抗治疗的NMOSDs患者(35/63)年复发率均显著降低(图1A、1B),用药后几个月内效果最明显,其中89%的患者(31/35)成功停用其他免疫疗法。同时纵向采集406份NMOSDs患者的血清学样本进行AQP4抗体检测。结果显示,在整个病程中,45%(10/22)接受利妥昔单抗治疗的患者、61%(17/28)接受其他免疫治疗者的AQP4-IgG亚类均以IgG1为主,IgG3、IgG2、IgG4出现的频率逐次降低。AQP4-IgG主要亚类在39%(24/61)的临床复发前后发生了转变,而远隔复发期(>8周)采样标本的转变率仅为16%(40/255)。AQP4-IgG主要亚类的转变可能是基因重组激活,即GCs活性的体现,如果这一过程是由原始B细胞重新进入GCs所驱动的,那么也应伴随着AQP4-IgM的产生。事实上,44%(22/50)的患者多次AQP4-IgM检测为阳性,并与48%(29/61)的复发密切相关,而远隔复发期样本中AQP4-IgM的阳性检出率仅为12%(37/316)(图1D、1E)。总体来看,AQP4-IgM的产生或AQP4-IgG亚类转移与NMOSD复发有关,GCs是复发期AQP4抗体合成的源头之一。
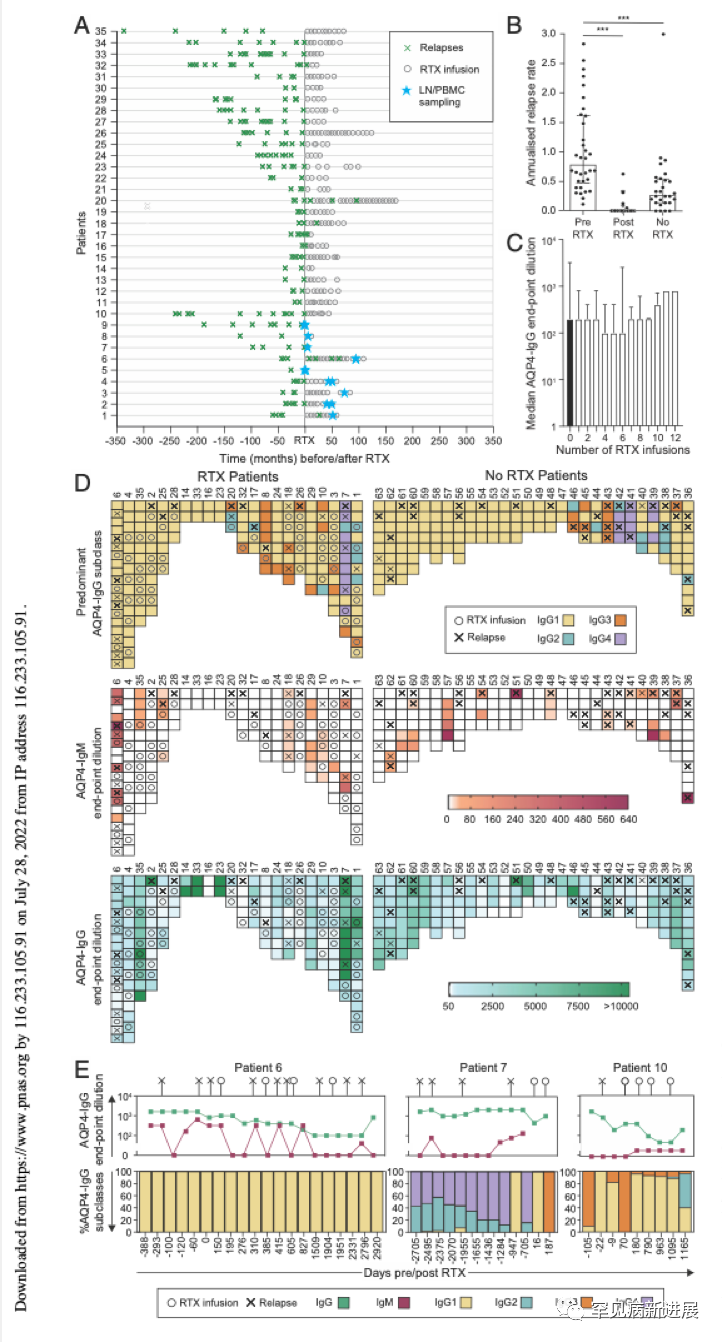
图1 NMOSD患者血清学表现与病情复发和利妥昔单抗的关系
二、利妥昔单抗可抑制dCLNs中AQP4-IgG的局部合成
对NMOSDs患者(n=14)和对照者(n=14)的dCLNs样本进行抗体分析(图2A),结果显示,在无明显标本感染的情况下,同一个体中dCLNs总IgG、IgM水平较血清分别低1500倍、500倍(图2B、图2C)。与血液标本相比,dCLNs中单核细胞、过渡型B细胞水平较低,而Tfh细胞比例更高。所有对照者dCLNs或血清样本中均未检出AQP4-IgGs,而未接受利妥昔单抗治疗的7例NMOSD患者dCLNs标本AQP4-IgG检测均呈阳性(图2D、2E),血清终点稀释度为1:100~1:3200,同一患者dCLNs的AQP4-IgG/总IgG值较血清高200倍(图2E、2F、2G),以上提示AQP4-IgG的局部(“结内”)合成。此外,有2例患者dCLNs样本AQP4-IgM检测阳性而血清学为阴性,也有力证明了这一观点(图2E)。相比之下,在利妥昔单抗给药后不同时间点采集的dCLNs样本中,只有18%(2/11)的患者检测到AQP4-IgG或AQP4-IgM (图2 G)。以上结果表明,利妥昔单抗可有效抑制AQP4-IgG的结内合成,甚至在用药前NMOSD患者dCLNs内就已存在AQP4特异性B细胞。
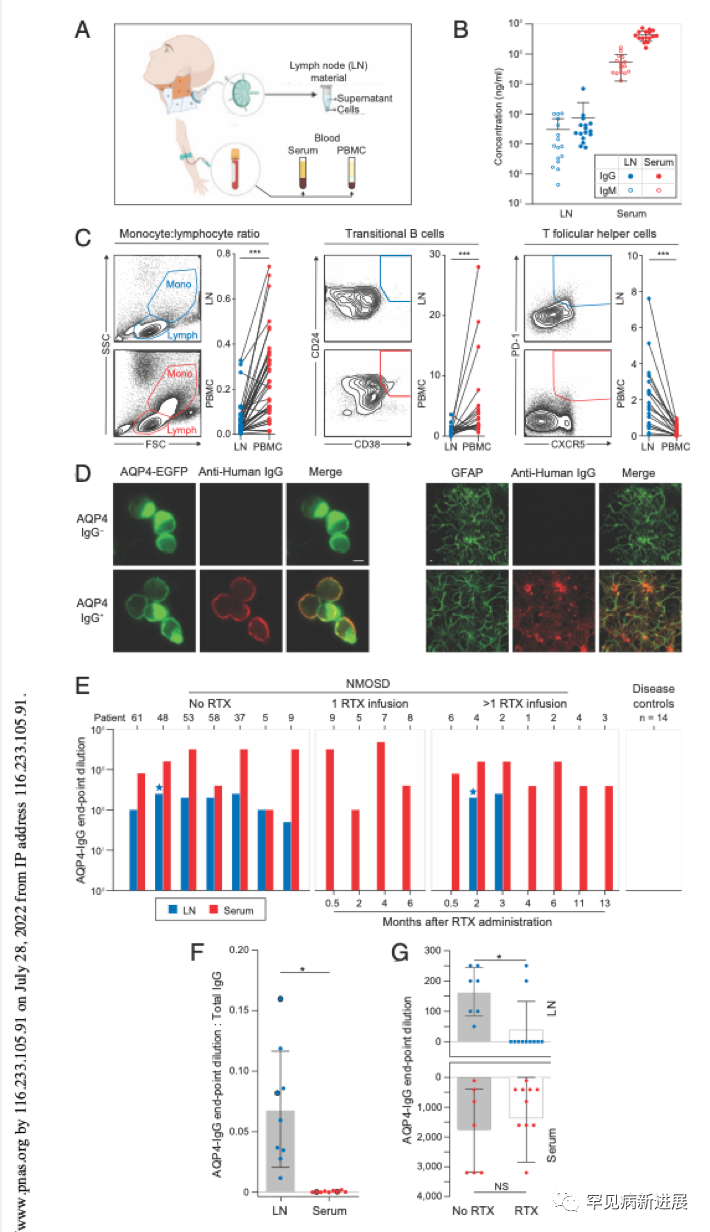
图2 颈淋巴结标本中存在AQP4抗体,利妥昔单抗给药后被清除
三、AQP4特异性B细胞在dCLNs和血液中的表达
从3名NMOSDs患者的dCLNs和血液标本中提取单个B细胞进行诱导分化,并检测上清液中AQP4-IgM、AQP4-IgG的活性(图3A)。11/8293的B细胞分泌AQP4-IgM/IgG,考虑到体外培养细胞的存活率为50%,这相当于dCLNs和血液标本中B细胞的0.2%(图3B、图3C)。共有原始B细胞(n=4)、双阴性(n=1)、IgD+(n=2)及IgD-(n=4)记忆细胞4种类型(图3A、图3D),所有细胞均表现为不同程度的VDJ基因重排,并伴有k:λ链2:1表达,其中来自原始细胞的同源重链和轻链未发生突变,但突变负荷增加。dCLNs中检测到的AQP4抗体都来自转换记忆(IgD-)细胞,2例上清液可检测到AQP4-IgG活性,其余均为AQP4-IgM。可见,从外周血单核细胞、dCLNs中分离出来的AQP4特异性B细胞起源于不同发育阶段B细胞亚群的遗传多样性。
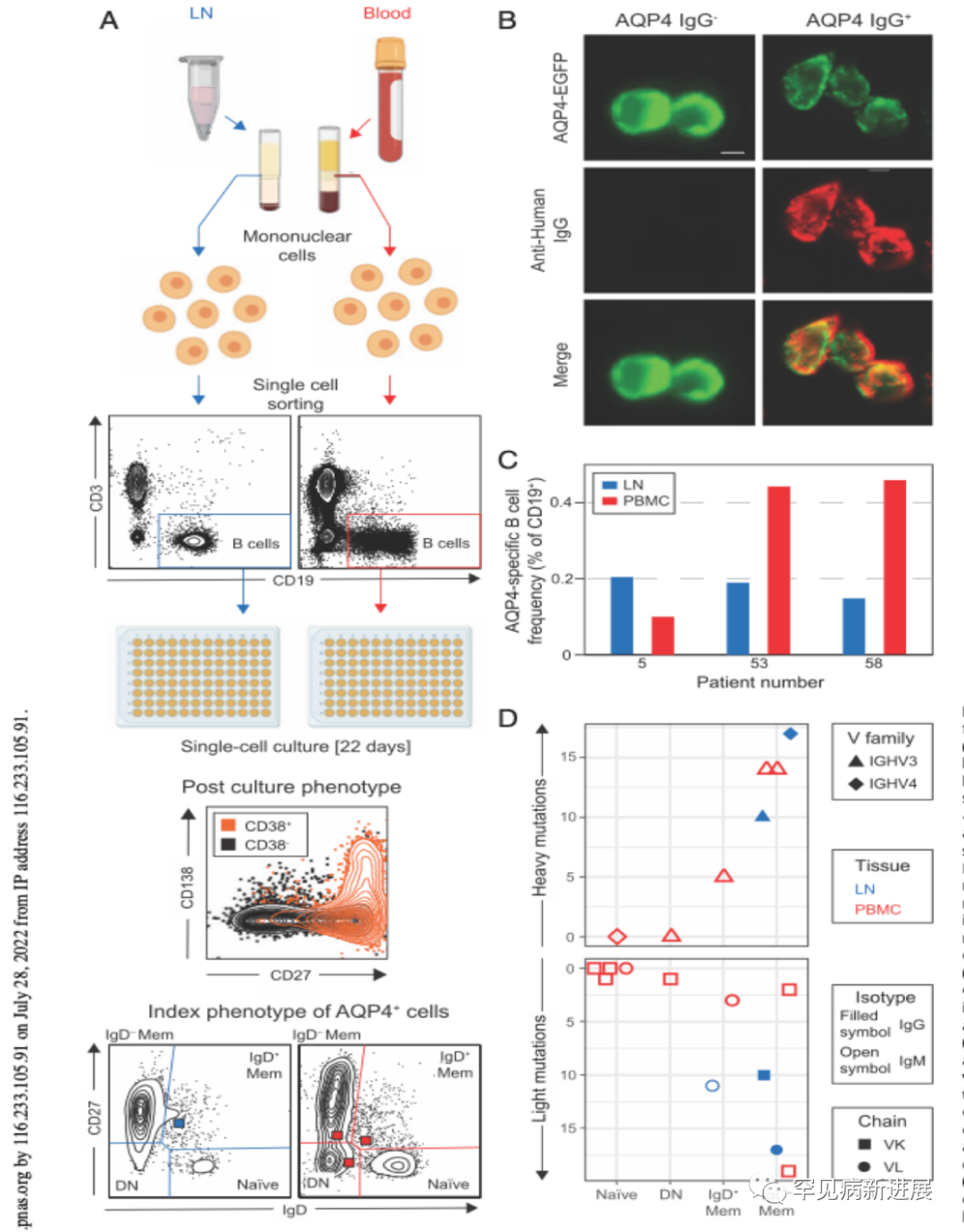
图3 NMOSDs患者dCLNs、血液中AQP4特异性B细胞的表达情况
四、利妥昔单抗可有效耗竭dCLNs中的B细胞
应用利妥昔单抗后患者血液、dCLNs中的B细胞水平分别下降了198倍、430倍,B细胞亚类、抗体分泌细胞、Tfh细胞无明显改变,CD20+ T细胞轻度减少(图4A)。利妥昔单抗对结内B细胞的消耗作用可持续数月,与未应用或单次用药的NMOSD患者相比,多次给药者效果最显著(图4B)。为了在个体内进行纵向验证,对4名患者进行给药前后的取样分析,结果显示,在应用利妥昔单抗后的3~12个月内,所有患者的血清AQP4-IgG水平不变,而dCLNs中的AQP4-IgG终点稀释度从1:100、1:250直至测不出,且结内AQP特异性B细胞消失或始终测不出(图4C)。可见,利妥昔单抗可显著减少dCLNs中B细胞和AQP4-IgGs水平,而对血清AQP4-IgGs没有影响。
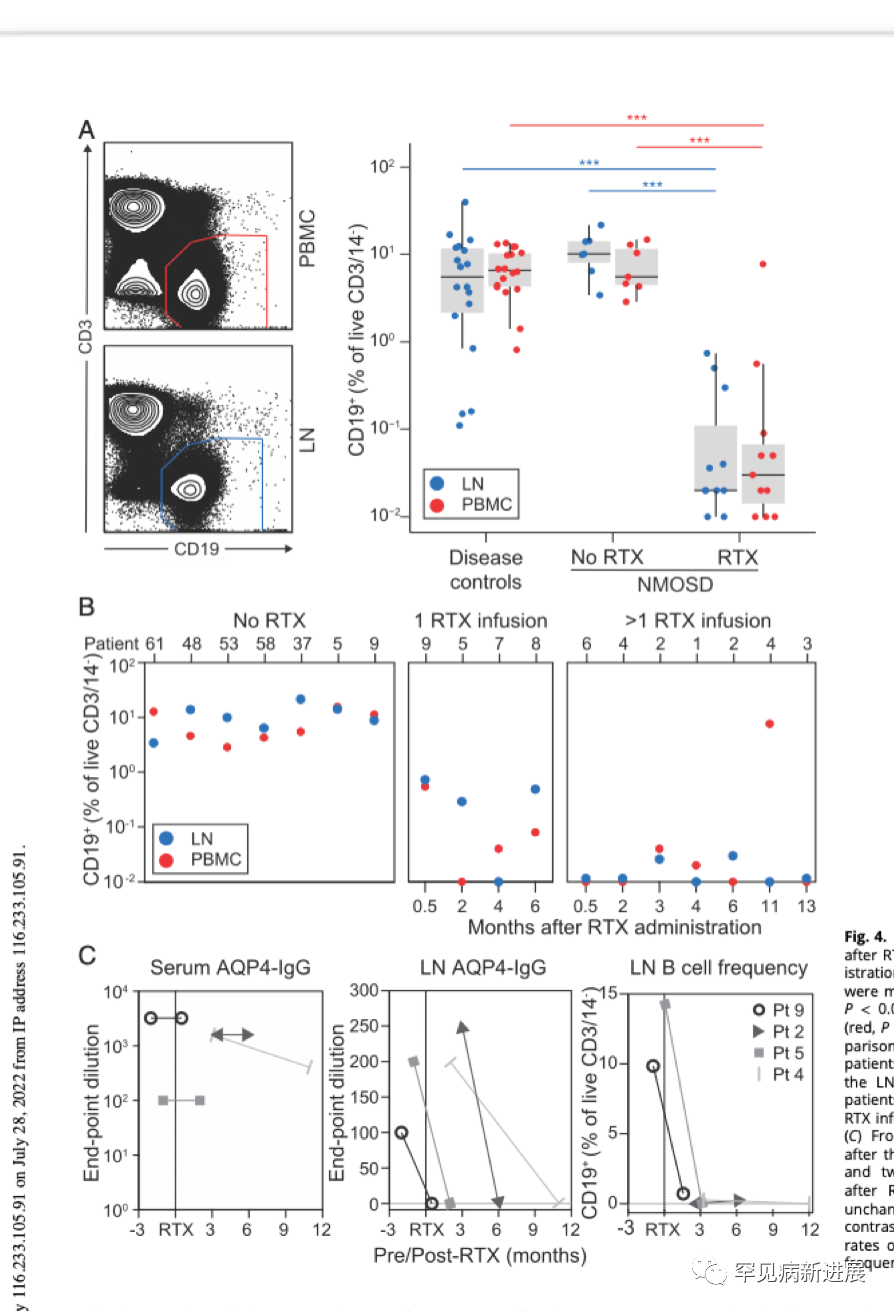
图4 注射利妥昔单抗后结内B细胞迅速耗竭
讨论 由此可见,纵向GCs活性是AQP4-IgG合成的潜在驱动因素,可作为预测NMOSDs患者复发的有效指标。利妥昔单抗给药前后的dCLNs采样分析表明,抗CD20治疗可显著消除NMOSDs患者结内B细胞和相应的AQP4特异性GCs活动,而血清中AQP4-IgG水平不受影响,即通过直接消除GCs的活性发挥作用。这也就解释了利妥昔单抗治疗NMOSDs起效快速,但患者血清抗AQP4抗体水平无改善的“临床-血清学”矛盾现象,后者可能与骨髓微环境中LLPCs的抗体合成有关。 在NMOSDs患者中,经典的抗原特异性GCs活性需考虑多种因素:血清AQP4-IgG水平比脑脊液要高出1000倍,这支持AQP4介导自身免疫的外周启动,早期外周B细胞即丧失耐受性;临床复发期间,患者血清AQP4-IgM显著升高,这提示GCs活性是由原始B细胞的优先招募而非IgG+记忆B细胞的重新激活驱动的。虽然其他区域淋巴结仍有待探索,但我们认为,dCLNs直接引流中枢神经系统(CNS)的淋巴液,极可能是CNS抗原驱动GCs活性发生的位点所在。 展望
本研究揭示了NMOSDs的免疫学驱动因素及利妥昔单抗治疗的起效机制,同时为分析自身免疫病中GCs的作用提供了范例。GCs活性的生物标志物可能具有广泛的临床适用性,未来有望作为病情监测、疗效及预后评估指标在人类自身免疫病的精准管理中扮演重要角色