8月18日,Krystal Biotech宣布,FDA已受理其在研基因疗法B-VEC(beremagene geperpavec)的生物制品许可申请(BLA),用于治疗营养不良性大疱性表皮松解症(DEB)患者。FDA同时授予该药物优先审查资格,PDUFA日期为2023年2月17日。此前,FDA已授予该药治疗DEB的孤儿药资格和再生医学先进疗法(RMAT)认定。
B-VEC(beremagene geperpavec)是一种基因工程改造而来的复制缺陷型HSV-1载体,包含两个COL7A1基因的拷贝片段,通过恢复DEB患者角质形成细胞和成纤维细胞中VII型胶原蛋白(COL7)的表达来实现治疗作用。B-VEC是一种非侵入性、局部应用、可重复给药的基因疗法,采用凝胶剂型设计,由皮肤科医生或初级护理医师直接应用于患者皮肤DEB伤口处,促进伤口愈合。
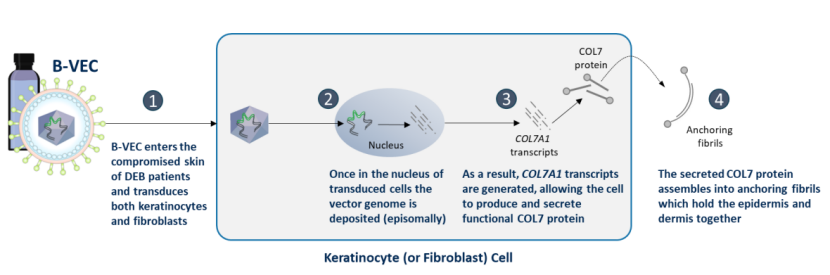
B-CEC的作用机制(来源:Krystal Biotech官网)
DEB是一种罕见且严重的单基因遗传性皮肤病,由编码COL7的COL7A1基因突变引起。这种突变会导致皮肤缺少将表皮与真皮固定在一起的基底膜结构,使得患者的皮肤和粘膜组织极度脆弱,轻微摩擦或创伤都会引起水疱和撕裂,开放性伤口会导致皮肤感染和纤维化,可能使手指和脚趾融合,并最终增加发生鳞状细胞癌的风险,严重时可能致命。目前全球尚无针对DEB获批的有效疗法。如果该药物成功获批,其将成为第一种有效的DEB治疗手段。

GEM-3试验方案(来源:Krystal Biotech官网)
该BLA得到两项含安慰剂对照的临床试验GEM-3和GEM-1/2的支持。关键性GEM-3临床试验达到其主要终点,在31例DEB患者中:在治疗3个月时,与安慰剂相比(20%),71%接受B-VEC治疗的患者伤口完全愈合(p<0.005);在治疗6个月时,与安慰剂相比(22%),67%接受B-VEC治疗的患者伤口完全愈合(p<0.005)。
B-VEC的耐受性良好,未报告药物相关严重不良事件或因治疗而停药。它的免疫原性特征(通过抗HSV-1和抗COL7抗体测定)与既往研究一致。
“我们很高兴FDA受理我们提交的BLA,并朝着可能带来一种从根本上治疗DEB的药物更近了一步。”Krystal Biotech联合创始人兼研发总裁Suma Krishnan说:“我们致力于与FDA密切合作,尽快将这种治疗方法带给DEB患者。”