最近,一种新的产品作为替代凝血不足的策略的替代因子。非替代疗法,包括联合单抗和再平衡产品,是患者的有效的预防选择。我们讨论了目前获得许可的A型血友病的治疗方法,并根据报道的每种产品回顾了抑制剂开发的风险,更进一步包括了关于新疗法的免疫原性的可用信息,如EHL-rFVIII产品和艾美赛珠单抗。

A型血友病是一种遗传性出血疾病,由凝血因子VIII(FVIII)的缺乏或完全缺失引起。这种疾病的特点是反复出血,主要在肌肉和关节,可发展为衰弱性关节病。严重A型血友病的定义为FVIII<1%,可导致损伤后频繁的自发性或过度出血。在中度和轻度A型血友病患者中,出血症状通常与损伤和手术相关。
A型血友病的主要治疗方法一直是使用FVIII浓缩物为基础的替代疗法。重组FVIII产品的开发不仅解决了依赖人血浆源可用性的问题,而且促进了新产品的开发。例如,目前有一种具有增强药代动力学特性的生物工程FVIII分子,即延长半衰期rFVIII产品。这些抗体抑制了FVIII的活性,并导致对FVIII替代治疗缺乏反应。抑制剂的发生影响了大约25-30%的严重A型血友病患者(EDs)。
A型血友病患者替代治疗的主要缺点是抑制剂的开发。这些抗FVIII抑制抗体是多克隆的,通常为IgG-4亚型,经常与IgG1亚型相关。重要的是非抑制性抗FVIII抗体也可能存在于A型血友病患者中,甚至存在于健康个体中。对于一些A型血友病患者,这些非抑制性抗体可以影响FVIII在循环中的半衰期,并影响替代治疗的疗效。
抑制剂的发展涉及一个复杂的机制,包括中枢和外周免疫耐受,了解这一机制可能有助于防止抑制剂的形成。抗FVIII异体抗体的发展机制始于抗原提呈细胞(APC)对注入的FVIII分子的内吞作用。这些FVIII分子在多肽中被蛋白水解降解,由通过T细胞受体(Th)呈现的主要组织相容性复合体(MHC)II类分子定义。需要共刺激信号来引起免疫反应并释放免疫调节分子。活化的T细胞与B细胞相互作用,促进分化和抗体形成。T滤泡辅助细胞(Tfh)有助于B细胞的激活,并负责产生T细胞依赖的体液反应。
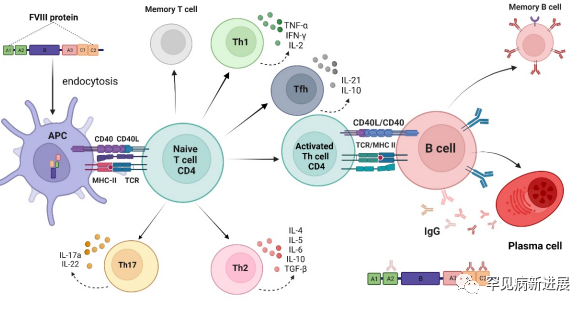
图1 抗fviii同种异体抗体形成的机制
在不可改变风险的遗传危险因素中,抑制剂家族史、非白种人患者和特异性免疫反应基因进一步导致抑制剂发展的更高风险。潜在的可改变的危险因素是抑制剂发展的非遗传危险因素。在治疗相关的危险因素中,可以提到治疗强度、使用方案、FVIII产品的来源,以及最近修改的FVIII浓缩液,如EHL-rFVIII。
因子VIII产物的免疫原性方面
在通过病毒灭活技术和重组产品的开发控制了血源性疾病后,抑制剂的开发成为A型血友病治疗中最关键的安全问题。因此,pdFVIII的纯度和与rFVIII生产相关的特性是抑制剂开发的危险因素。
根据FVIII暴露情况,患者可以分为两个不同的组:以前未接受治疗的患者(PUPs)和以前接受过治疗的患者(PTPs),并且患者必须没有接受过任何因素浓缩治疗。研究发现,抑制剂的发育在PUPs中更为常见,因为他们对外源性FVIII不耐受。因此,PUPs研究对于确定最相关的抑制剂危险因素,如F8突变、家族史和其他遗传和非遗传因素至关重要。ptp通常包括以前暴露于FVIII浓缩物超过75至150次急诊科的患者和在150多个急诊科后对外源性FVIII产物耐受的患者。
目前在使用rFVIII产品治疗的严重A型血友病的PUPs和MTPs中观察到抑制剂的风险更高。rFVIII较高的免疫原性可能与不同的翻译后修饰、不同细胞系的产生以及其他蛋白的缺失有关,如血管性血友病因子(VWF)。
A型血友病的治疗方法
目前,A型血友病的预防可分为替代疗法和非替代疗法。替代疗法包括pdFVIII和rFVIII产品,包括标准半衰期(SHL)rFVIII和EHL-rFVIII浓缩物。直到2022年,艾美赛珠单抗是唯一获得许可的非替代疗法。
1.替代治疗:血浆来源的因子VIII浓度
pdFVIII产品是由数千名献血者的混合血浆产生的,导致在这些样本中发现的FVIII序列存在相当大的异质性。每个pdFVIII浓缩物可能因所使用的制造过程的不同而有所不同,这主要与纯化方法、病毒失活过程和用于稳定和保护FVIII分子的蛋白质有关。
在制造过程中,FVIII是从大量汇集的人血浆中分离出的冷沉淀中纯化的。FVIII最终通过使用多重沉淀、亲和层析或离子交换层析的色谱技术进行纯化。一些pdFVIII浓缩物含有大量的VWF,被认为是含有VWF的pdFVIII。还有一些pdFVIII产品,其中添加白蛋白来稳定和保护FVIII分子。另外,其他小的血浆蛋白和其他分子也可以存在于pdFVIII浓缩物中。
不同血浆蛋白的存在可能会影响pdFVIII浓缩物的免疫原性。降低A型血友病患者治疗性FVIII的免疫原性的关键伴侣分子是VWF。有证据表明,使用含VWF的pdFVIII治疗的患者抑制剂的发生率更低。其他被认为参与降低pdFVIII免疫原性的成分包括转化生长因子(TGF-β)和IL-10。
抗原竞争和旁观者抑制是参与在使用pdFVIII产品治疗的患者中观察到的抑制剂减少的机制。针对pdFVIII中这些其他蛋白成分的T调节细胞(treg)的存在可能会引起旁观者抑制,抑制FVIII特异性T细胞或促进其向treg的分化。(图2)
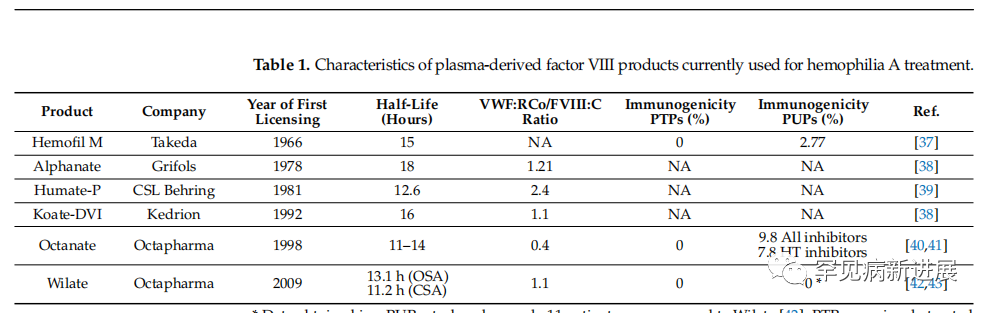
图2 总结了目前可用于治疗A型血友病的pdFVIII产品的主要特点。
2.替代治疗:标准半衰期(SHL)重组FVIII产品 rFVIII产品的开发引入了一个显著的安全相关优势,增加了之前在制造pdFVIII中使用的病毒灭活过程:逐步去除这些产品中的动物和人类蛋白质。第一代rFVIII浓缩物使用细胞培养基中的动物源性蛋白,并加入人血清白蛋白来稳定最终的rFVIII配方。第二代rFVIII浓缩物在细胞培养基中使用人或动物来源的蛋白。第三代rFVIII浓缩物是无血浆/白蛋白的产品。现在我们可以进一步包括第四代,这是不同的所使用的细胞谱系,而第四代rFVIII是在人胚胎肾细胞系中产生的,这确保了人类特异性的翻译后蛋白加工。 FVIII包含6个硫酸盐酪氨酸残基,它们在FVIII凝血途径的激活以及FVIII和VWF之间的相互作用中起着关键作用。位于酪氨酸1680上的残基是与VWF相互作用所必需的。FVIII是一种高度糖基化的蛋白,FVIII的糖基化的模式因FVIII产生细胞的不同而不同。这可以部分解释使用pdFVIII和rFVIII治疗的患者之间或不同细胞系产生的rFVIII之间抑制剂发生的差异。(图3)
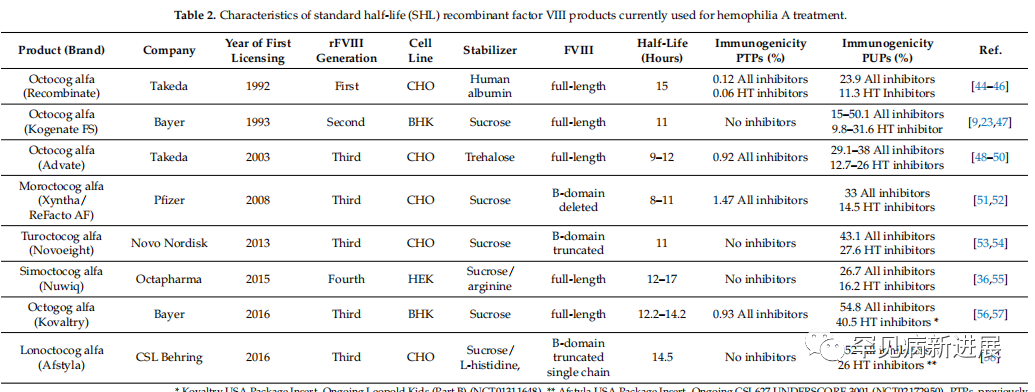
图3 目前可用于A型血友病治疗的SHL-rFVIII产品之间的差异
3.替代治疗:延长半衰期(EHL)重组FVIII产品 生物仿制药生产的技术进化,如重组凝血因子,使科学家们能够探索新的替代品。为了满足用户友好给药方案的需求,已经开发了EHL凝血因子浓缩物。新的FVIII生物工程分子在半衰期方面取得了微小的改善——仅为SHL-rFVIII产品的1.5-1.8倍。FVIII药代动力学(PK)参数的适度改善可能是由于VWF的半衰期,它在循环中与FVIII结合,并保护FVIII免受其他快速清除。 最近BIVV001被开发出来。这种新的EHL-rFVIII结合了两种新技术,包括一个融合到二聚体Fc的rFVIII分子、VWF的D0D3结构域和两个XTEN亲水性多肽。与VWF D0D3结构域的共价连接阻止了rFVIII和内源性VWF之间的结合。BIVV001的半衰期是SHL-rFVIII产品的3-4倍,其临床效益与EHL重组因子IX产品所观察到的相似。
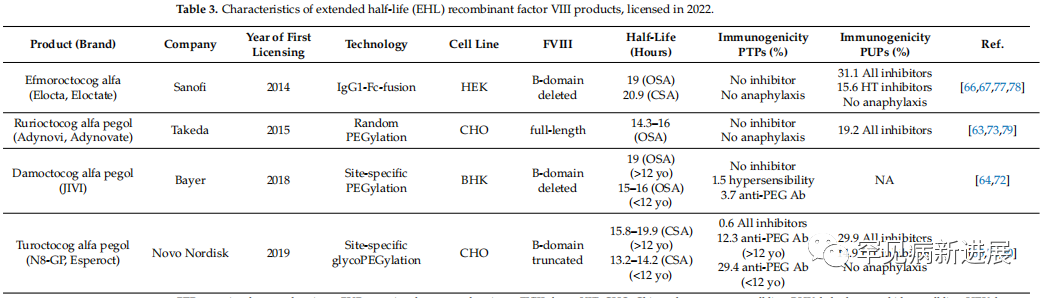
上图是延长半衰期(EHL)重组因子VIII产品的特性
EHL-rFVIII产品的出现是更灵活的治疗方案,可根据现实世界的临床使用和患者生活方式。这些特征有助于改善治疗个体化,通过减少输液次数和/或针对更高的谷水平,从而获得更好的依从性,因此,对治疗效果产生相关影响。 4.A型血友病的非替代治疗:艾美赛珠单抗 艾美赛珠单抗是第一个被许可用于预防的非替代药物,用于预防或减少A型血友病患者出血发作的频率。艾美赛珠单抗是一种人源化双特异性单克隆抗体,与激活因子IX和因子X具有结合位点,模拟了FVIII的共因子活性。此外,艾美赛珠单抗是皮下给药,从而克服了与频繁静脉注射相关的负担,无论年龄如何,效果都相同。 艾美赛珠单抗具有较低的免疫原性,在668例有或没有FVIII抑制剂的男性A型血友病患者中有34例(5.1%)报告了抗药物抗体(ADAs),这些患者来自7项3/3b期临床研究。患者中位年龄为28岁,其中12岁以下患者98例。14/34(41.2%)A型血友病患者中ADAs是短暂的,只有4/668(0.6%)与艾美赛珠单抗浓度下降相关。其中,只有1例(0.1%)因失去疗效而停用了emicizumab。
结论
A型血友病的治疗在过去的几十年里有了显著的改善。然而,FVIII抑制剂的出现损害了用于A型血友病治疗的替代产品的疗效。一些危险因素与抑制剂的开发有关,包括FVIII浓缩物的类型和种类。了解和认识FVIII产品的免疫原性已成为近几十年来的主要研究兴趣之一。
新的生物工程凝血因子,如EHL-rFVIII产品被开发出来,以提高预防的有效性和改善频繁静脉给药的负担性。然而,涉及EHL-rFVIII浓缩物的免疫原性仍然是与使用这些产品相关的主要不良事件。艾美赛珠单抗是一种非替代疗法,是a型血友病患者的一种独特的替代方案,无论是否存在抑制剂,都可以有效地预防出血。