当地时间9月29日,专注于基因治疗罕见病的企业Sarepta Therapeutics宣布向FDA提交SRP-9001治疗杜氏肌营养不良症(DMD)患者的生物制品许可申请(BLA),以寻求加速批准。
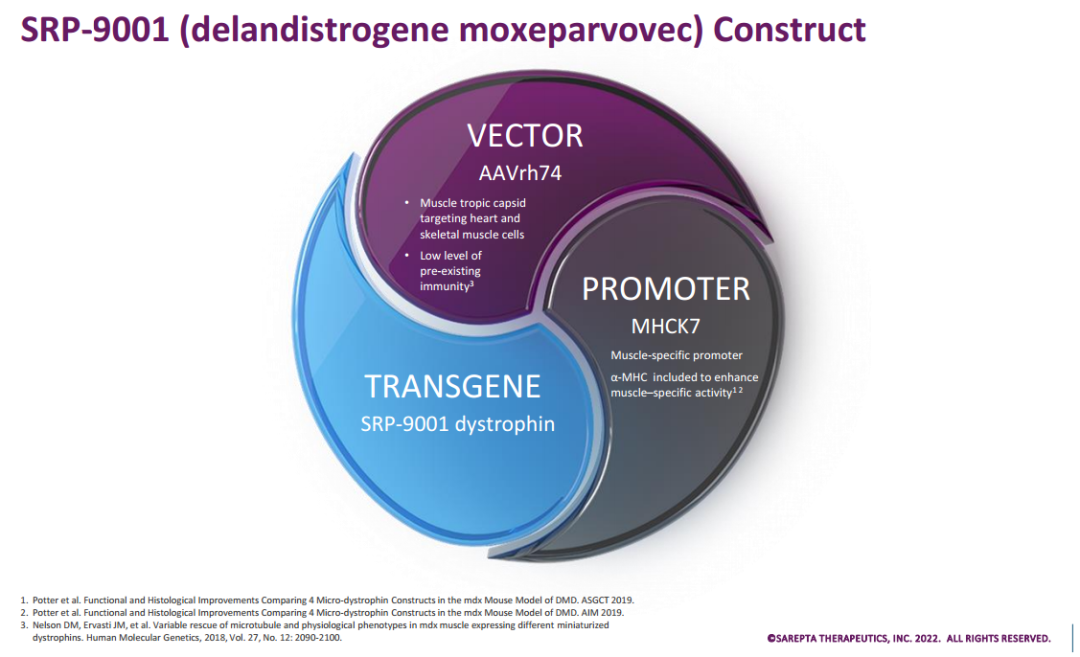
杜氏肌营养不良症(DMD)是一种罕见的致命神经肌肉遗传疾病。全世界每3500-5000名新生男性中就有1人发病。DMD是由编码肌营养不良蛋白的基因发生变化或突变引起的,一般在5岁前发病,临床特点为进行性对称性肌无力,以肢体近端受累多见,起病常于下肢开始。 SRP-9001是一款在研的基因转移疗法,旨在将SRP-9001输送到肌肉组织,靶向能够产生抗肌萎缩蛋白的功能成分,由Sarepta与罗氏合作开发,Sarepta负责SRP-9001的全球开发和生产。 SRP-9001的组成成分 此次BLA资料包括积极的临床前、生物标志物和临床功能结果。在临床试验中,除了一致的安全性特征外,SRP-9001还在多个时间点(包括治疗后1年、2年和4年)显示阳性结果。另外,该项BLA还包括SRP-9001-101、SRP-9001-102、SRP-9001-103(也称为ENDEAVOR)研究的疗效和安全性数据,以及这3项临床研究的汇总分析结果。SRP-9001蛋白表达定量通过蛋白免疫印迹法测量,并得到免疫荧光法的支持,生物标志物和临床功能获益进一步支持疗效。 Sarepta Therapeutics总裁兼首席执行官Doug Ingram表示:“每时每刻,无情的DMD疾病都在夺走美国数千名儿童的未来。Sarepta 提交BLA以加速批准SRP-9001疗法,这是我们一个重要里程碑。如果获得批准,SRP-9001将成为第一个可用于DMD患者的基因疗法。我们非常感谢参与SRP-9001试验的家庭,以及参与指导并在实现这一里程碑方面发挥关键作用的参与临床研究人员和专家。” 2020年7月,SRP-9001获得FDA快速通道资格。后来,SRP-9001还在美国获得了罕见儿科疾病(RPD)称号,并在美国、欧盟、瑞士和日本获得孤儿药资格。