图片来源:摄图网
武田制药(Takeda)近日宣布,美国食品和药物管理局(FDA)已受理Takhzyro(lanadelumab,拉那芦人单抗注射液)的一份补充生物制品许可申请(sBLA)。该sBLA旨在寻求潜在地扩大Takhzyro的使用:用于2岁至12岁以下儿科患者,预防遗传性血管水肿(HAE)发作。
FDA已授予sBLA优先审查,并预计将于2023年上半年作出审查决定。目前,6岁以下HAE儿童人群,没有批准的预防性治疗方案。如果获得批准,Takhzyro将成为这一人群(6岁以下儿童)的第一种预防性治疗药物。
此次sBLA基于3期SHP643-301研究(SPRING,NCT04070326)的数据。该研究是第一个也是唯一一个针对12岁以下HAE患者的开放标签3期试验。试验的阳性结果已在2022年欧洲过敏与临床免疫学学会(EAACI)大会上公布。这些结果与在成人和青少年HAE患者中开展的早期研究一致。
SHP643-301(SPRING)是一项多中心、开放标签3期研究,在2岁至12岁以下HAE儿科患者中开展,旨在评估Takhzyro预防HAE急性发作的安全性、药代动力学(PK)、药效学和临床活性/结果。在该研究的52周治疗期内,年龄在2岁至6岁以下的儿童接受每4周一次(Q4W)150mg剂量Takhzyro、6岁至12岁以下的儿童接受每2周一次(Q2W)150mg剂量Takhzyro。
该研究已经完成,并已达到目标。数据显示,与基线相比,Takhzyro预防性治疗将儿童HAE发作率平均降低了94.8%,从每月1.84次降至治疗期间的0.08次。在52周治疗期间,大多数患者(76.2%)没有发作,平均99.5%的天数没有发作。
研究期间未报告死亡或严重治疗期不良事件(TEAE),也没有患者因TEAE退出研究。最常见的TEAE是注射部位疼痛,大多数TEAE的严重程度为轻度或中度。这些结果与在成人和青少年HAE患者中开展的早期研究中观察到的Takhzyro良好疗效和安全性相一致。
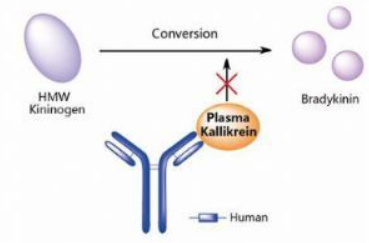
Takhzyro-lanadelumab作用机制(图片来源:pharmacodia.com)
遗传性血管水肿(HAE)是一种罕见的遗传性疾病,可导致身体各个部位(包括腹部、面部、足部、生殖器、手部和喉咙)反复发作的水肿-肿胀。肿胀会使人虚弱和疼痛。阻塞气道的发作可能导致窒息,并可能危及生命。据估计,全世界每50000中就有1人患有HAE,该病常常被低估、诊断不足和治疗不足。
Takhzyro是第一个被批准治疗HAE的单抗类药物,于2018年8月批准上市,适应症为:用于12岁及以上HAE患者,常规预防HAE发作。Takhzyro不适用于HAE发作的急性治疗。Takhzyro是一种全人单抗,可特异性结合并抑制血浆激肽释放酶的活性。该药利用重组DNA技术在中国仓鼠卵巢细胞(CHO)中产生。
Takhzyro通过皮下注射给药,在HAE患者体内的半衰期为14天,经过医疗专业人员的培训后,由患者自己给药或由护理人员给药,可在1分钟或更短时间内完成注射。用药方面,Takhzyro的推荐起始剂量为每2周300mg。在接受治疗病情控制良好无发作的患者中,可以考虑每4周300mg剂量,特别是在低体重的患者中。根据区域授权,Takhzyro可作为300mg剂量小瓶或预充式注射器提供。
原文出处:U.S. Food and Drug Administration Accepts Takeda’s Supplemental Biologics License Application for Use of TAKHZYRO® (lanadelumab-flyo) to Prevent Hereditary Angioedema (HAE) Attacks in Children 2 Years of Age and Older