10月31日,Actinium Pharmaceuticals发布公告,宣布其CD45单抗Iomab-B(apamistamab)治疗复发性或难治性急性髓系白血病(r/r AML)患者的关键性III期SIERRA研究达到主要终点。鉴于此积极结果,Actinium计划在2023年向FDA提交该产品用于治疗55岁以上r/r AML患者的生物制品许可申请(BLA)。

AML是由于外周血、骨髓或其他组织中髓系原始细胞克隆性增生所致的髓系肿瘤,主要临床症状包括发热、出血、贫血,可导致感染、高尿酸血症的并发症。大多数AML患者会复发,r/r AML患者预后较差,5年生存率约为27%。多项研究表明,接受骨髓移植(BMT)的患者的生存率增加,然而,由于现有疗法无法缓解患者的疾病状况或者毒性太大,导致绝大多数患者没有机会接受BMT。
Iomab-B(初始研发代号:BC8)是由Fred Hutchinson癌症研究中心开发一种靶向CD45的放射免疫疗法,旨在通过同时快速耗竭特异性表达CD45的血液癌、免疫细胞和骨髓干细胞来增加患者接受BMT的机会。2012年7月,Actinium与该中心达成协议,获得Iomab-B的全球开发和商业化权利。2022年4月,Immedica Pharma与Actinium达成协议,获得Iomab-B在欧洲、中东和北非的商业化权利。Iomab-B已获FDA和欧洲药品管理局 (EMA) 授予的孤儿药资格。
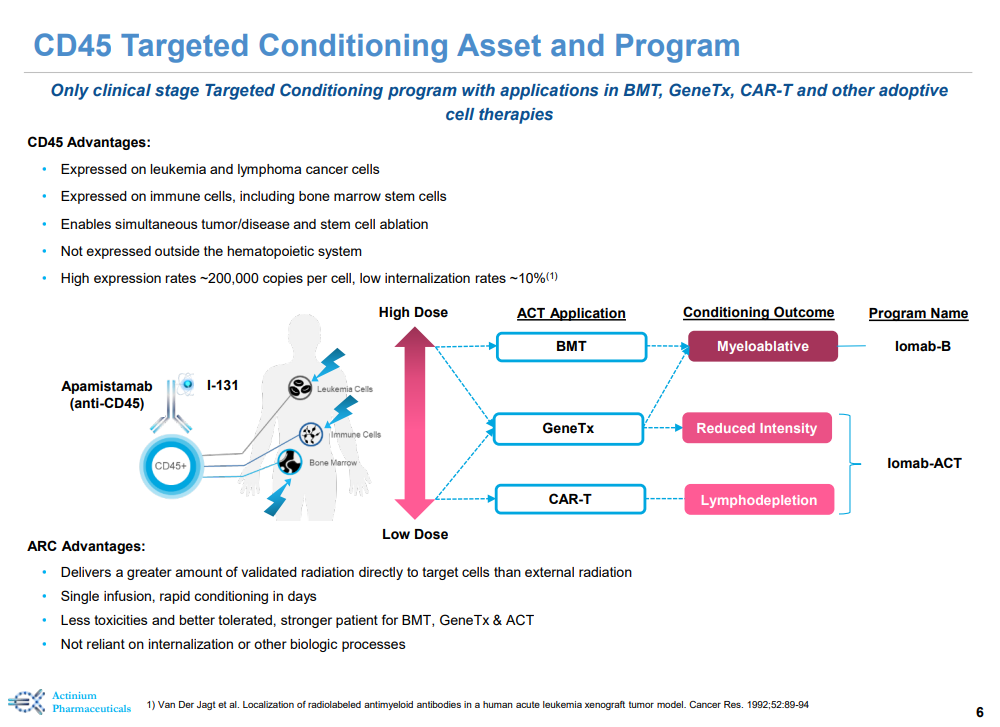
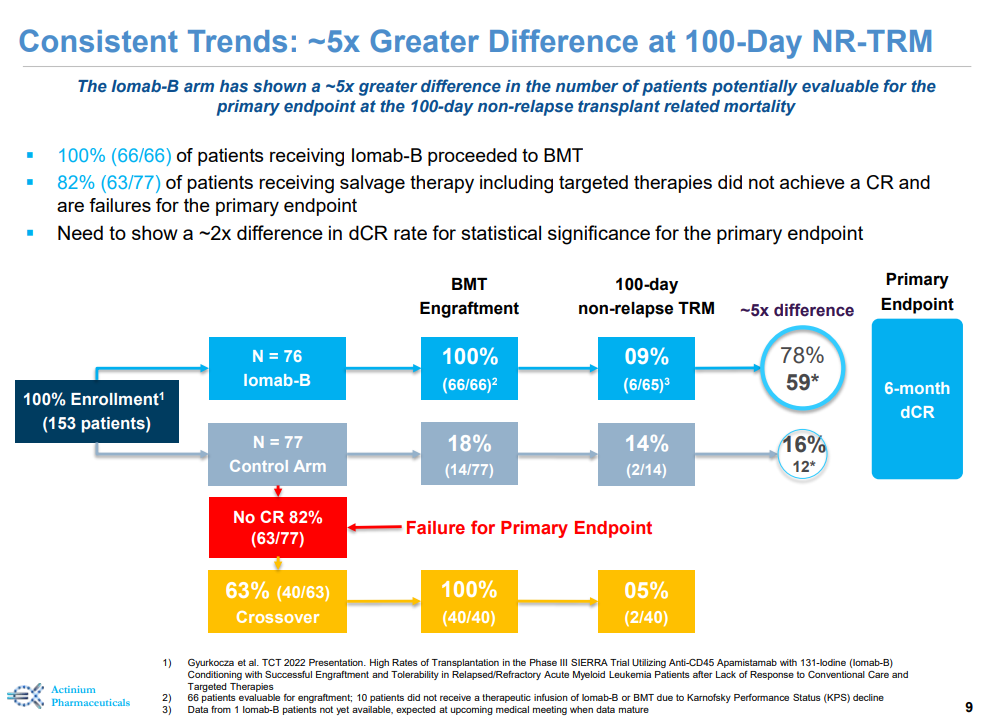
SIERRA研究是一项多中心、随机、开放标签的III期临床试验,共纳入153例患者(年龄≥55岁),旨在评估Iomab-B对比常规治疗方案治疗活动性(白血病原始细胞>5%)、复发性或难治性急性髓系白血病患者的有效性和安全性。常规治疗方案包括阿糖胞苷和柔红霉素等化学疗法以及Bcl-2抑制剂 (Venetoclax)、FLT3抑制剂和IDH 1/2抑制剂等靶向药物。试验的主要终点为持久的完全缓解 (dCR),次要终点包括总生存期和无事件生存期(EFS)。
数据显示,Iomab-B组患者实现了6个月的dCR,具有统计学意义 (p<0.0001),并且100%的患者接受了骨髓移植(BMT),而安慰剂组仅18%的患者接受了BMT。此外,Iomab-B具有良好的耐受性,与先前的临床数据一致。
截至目前,全球尚无CD45靶向疗法获批上市,仅6款进入临床阶段,而Iomab-B是唯一一款进入III期阶段的产品。