2022年12月1日,Roivant Sciences(简称“Roivant”)和辉瑞(“Pfizer”)共同宣布,两家成立合资公司Vant。
根据协议条款:(1)Vant将全权负责资助RVT-3101在溃疡性结肠炎(UC) 以及其他炎症和纤维化疾病中的全球开发,并拥有在美国和日本的商业权利。(2)辉瑞在 Vant 中拥有 25% 的股权,并在美国和日本以外拥有RVT-3101的商业权利。(3)Vant拥有与辉瑞合作开发下一代 TL1A 定向抗体的独家选择权,该抗体最近进入了 1 期临床;在进行2期试验(预计在2025年)之前,Vant将有权与辉瑞签订一项各50%成本分担,共同商业化的全球开发协议。

|关于RVT-3101
RVT-3101是一种靶向TL1A的全人源单克隆抗体,通过抑制TL1A靶向炎症和纤维化途径,是一种潜在的first-in-class的药物。TL1A已被证明可以通过刺激TH1和TH17途径来调节炎症和纤维化的位置和严重程度,以及激活成纤维细胞。因此,RVT-3101有可能通过击中多个炎症途径以及纤维化途径来提供更大的疗效。目前,该药物处于UC 的2b期开发阶段。
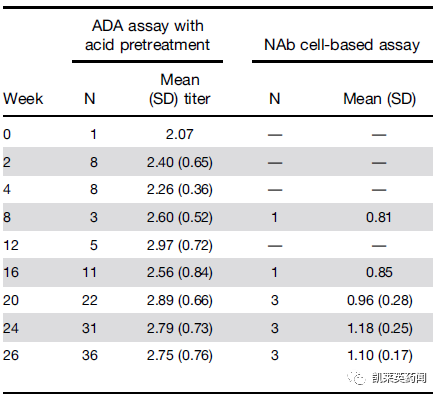
此前,RVT-3101已在一项早期的2期TUSCANY研究对50名患者进行了评估,在这项 2a 期、多中心、单臂、开放标签研究中,评估了对中度至重度UC 患者的安全性、耐受性、疗效、药代动力学和免疫原性。受试者每 2 周接受 500 mg静脉注射PF-06480605,共 7 剂,随访期为 3 个月。主要安全性和有效性终点分别是不良事件 (AE) 的发生率和第 14 周的内窥镜改善 (EI)。次要终点包括总可溶性TL1A(游离/药物结合)(sTL1A)、抗药物和中和抗体的发生率、PF-06480605浓度以及粪便钙保护蛋白和高敏c反应蛋白的变化。
结果显示:
在 109 例治疗中出现的 AE 中,18 例与治疗相关。最常见的 AE 是UC 疾病恶化和关节痛。报告了四种严重的 AE,没有死亡,也没有恶性肿瘤。

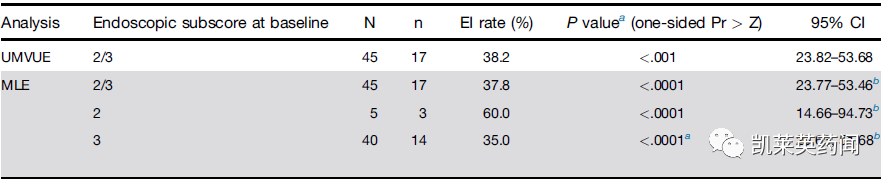
第 14 周,在统计学显着比例的参与者中观察到 EI(38.2%)。
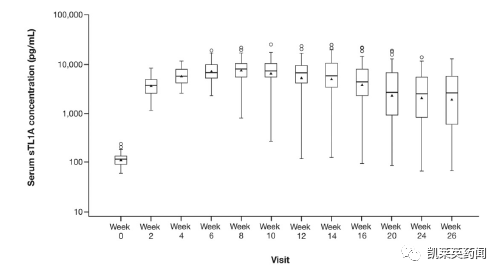
sTL1A随时间持续上升。
治疗后观察到轻微组织学病变(Robarts组织病理学指数≤5:33.3%;Geboes指数≤3.2:47.6%)。
41 名参与者 (82%) 的抗药抗体测试呈阳性,5 名 (10%) 的中和抗体测试呈阳性。
目前,RVT-3101正在一项大型全球2b期研究(TUSCANY-2)中对245名患有中度至重度溃疡性结肠炎的成年受试者进行评估。TUSCANY-2的诱导部分已经完成,维持治疗部分仍在进行中。
| 关于TL1A
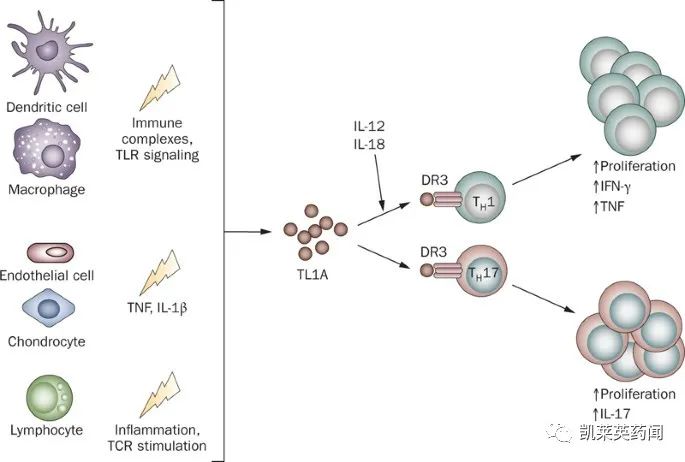
血管内皮生长抑制因子(VEGI/TL1A)作为一种血管生成抑制剂, 主要通过结合死亡受体3(DR3)发挥其功能,TL1A还可以协同促进IL-4、IL-12和IL-23的产生,并通过Th1、Th2和Th17细胞增加DR3的表达,以促进炎症。TL1A被发现是肠道炎症的关键介质,目前被开发用于治疗溃疡性结肠炎、克罗恩病、炎症性肠炎等。
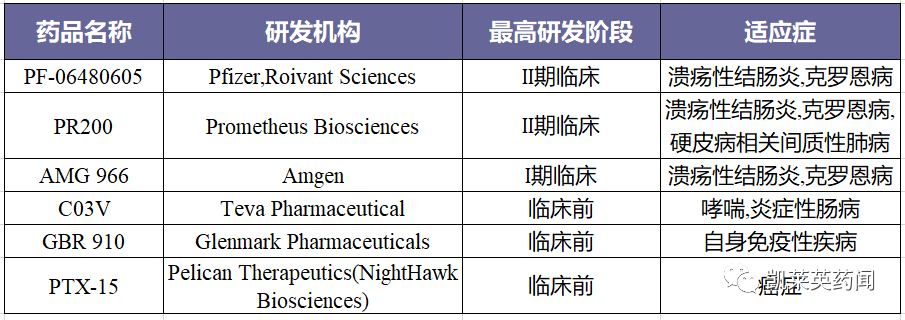
据不完全统计,目前在研的药物有6种。
|关于Roivant
Roivant成立于2014年,其目标是更快,更有效地为患者开发和提供药物。公司采用Hub-and-spoke/中心辐射的模式进行业务版图的构建,以创建公司所描述的“研发中的新型产业组织形式”。Roivant旗下的每个子公司都作为一个独立的实体运营,以保留初创公司的敏捷灵活性和创新创业精神;同时,每个子公司都可以利用和共享来自母公司和其他由数据驱动的子公司的资源来支持其相关药物的开发和商业化。
公司近期的研发管线
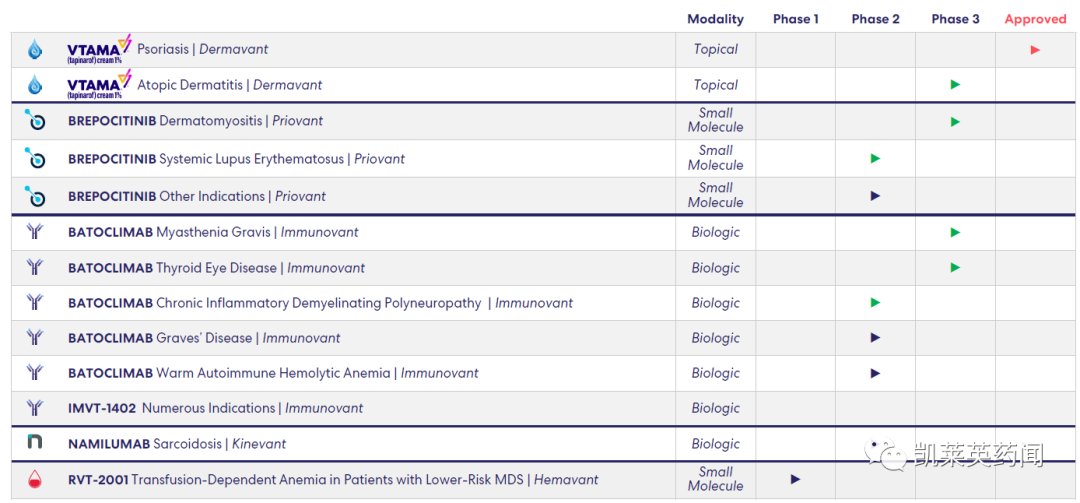
自2014年成立以来,Roivant通过自主创建/收购合并了21家子公司,其中4家已成功上市,5家被日本住友制药收购;投入开发了40多种涵盖广泛疾病领域的药物管线,开展了8项积极的药物临床III期研究,其中有3款药物已经获得FDA的批准。其知名开发合作伙伴包括武田、默克、GSK、阿斯利康、卫材、第一三共、齐鲁等。
近年来的交易情况
