自2017年问世以来,被称为CAR-T的癌症疗法彻底改变了一些血液肿瘤的治疗。这种疗法使用经过基因改造的免疫细胞来锁定癌细胞并摧毁它们。
现在,圣路易斯华盛顿大学医学院(WashU)的研究人员通过研究患有类似多发性硬化(MS)的自身免疫性疾病的小鼠,表明同样的方法可以用来清除引起自身免疫的无用细胞。这项研究成果发表在《免疫学科学》(Science Immunology)网络版上,将免疫疗法的强大工具扩展到一类通常使人衰弱且难以治疗的疾病。

T细胞
CAR-T疗法的核心是免疫系统的T细胞,这是人体发挥免疫作用的关键元素,对细菌、病毒和癌细胞等威胁做出反应,通过协调免疫攻击,杀死外来生物和受感染或癌细胞。但每隔一段时间,T细胞就会将健康细胞误认为受感染的细胞,并将“武器”对准身体自身的细胞和组织,从而引发自身免疫性疾病。
多发性硬化(MS)
多发性硬化是一种以中枢神经系统炎症脱髓鞘病变为主要特点的免疫介导性疾病。神经纤维上的髓鞘是保护神经元的重要物质,它可以促进神经冲动在神经元上的快速传递,因此多发性硬化的患者,神经冲动的传送会受到程度不同的影响,造成一系列的症状。
目前认为MS可能是一种由多种因素共同作用的疾病,研究提出了自身免疫、病毒感染、遗传倾向、环境因素及个体易感因素综合作用的多因素病因学说。研究发现,本病最初发病或以后的复发.多发生过一次急性感染。
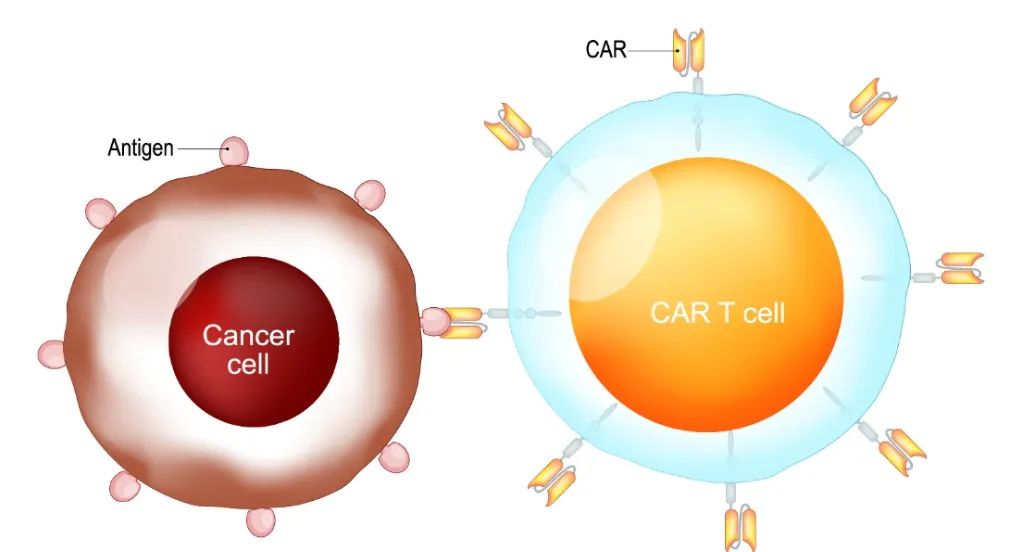
“我们能够使用CAR-T细胞实现只清除引起自身免疫的免疫细胞,而不是保护免受病毒或其他感染的免疫细胞。”共同资深作者Chyi Song Hsieh博士对研究作了说明,并补充道:“我们的CAR-T细胞对患有MS样疾病的小鼠非常有效。”Hsieh博士是Alan A.and Edith L. Wolff风湿病学教授以及医学和病理学与免疫学教授。
在CAR-T癌症疗法中,医生提取患者自身的T细胞,对其进行改造,使其识别并大力攻击他或她的特定癌症,然后把它们放回体内,执行“寻找并摧毁”的任务。受到这种方法的启发,研究人员开始创造CAR-T细胞,用于寻找和摧毁导致MS的流氓T细胞。这个想法是让CAR-T细胞的功能类似于警察部门的内部事务办公室,根除T细胞免疫作用中的“害群之马”,同时保留对自身有益的的T细胞来保护身体。
“患有多发性硬化真的会降低生活质量,虽然现有的治疗方法可以减缓疾病的进程,但无法治愈,且还有着副作用。”共同作者,神经学、病理学和免疫学的副教授Gregory F. Wu博士说道,“我相信这是一种完全可以治疗的疾病,CAR-T细胞可能是更好的治疗方法。”
首先,研究人员制作了一些诱饵。他们设计了一种分子,将髓磷脂中的蛋白质片段与激活T细胞的蛋白质结合起来。只有以髓磷脂为目标的T细胞,也就是所谓的“害群之马”才会对这种混合分子产生反应。然后,他们将诱饵分子装载到一种被称为杀伤性T细胞的特异性T细胞上。任何误入歧途的T细胞都会被杀伤T细胞消灭。这是研究员最初的设想。
为了验证该方法是否有效,研究人员将目光转向患有MS样症状的小鼠。用经过改造的CAR-T细胞治疗这些小鼠,可以预防那些尚未出现问题的小鼠的疾病,并减少那些已经显示出神经系统效应的小鼠的疾病迹象。
Hsieh博士说:“我们正在努力改进CAR-T细胞,让它们更有效地攻击并延长持续的时间,这样我们就可以获得更好的治疗结果。目前,无法判断谁会或何时会患上MS,因此预防疾病是不现实的,但我们可以实现疾病的治疗,我认为CAR-T方法看起来很有希望。”
CAR-T方法的美妙之处在于,通过交换诱饵分子中的蛋白质片段,杀伤性T细胞可以重新导向不同的流氓免疫细胞,以治疗不同的疾病。
“我在诊所里见过一些患者,他们患有一种罕见的疾病,叫做髓鞘少突胶质细胞糖蛋白(MOG)抗体疾病,这种疾病与MS非常相似。”Wu博士介绍曾经遇到的与MS相似的罕见疾病,“与复杂的多发性硬化不同,我们确切地知道MOG抗体疾病的目标是什么。我希望我可以为我的病人去除这些自我反应细胞,但我们没有办法做到。现在,我们正致力于使用患者自身的免疫细胞来创造CAR-T细胞,从而消除这些自身反应性T细胞。”
除了Hsieh博士和Wu博士,该研究团队还包括共同作者医学助理Nathan Singh教授和病理学和免疫学副教授Takeshi Egawa博士。
总的来说,WashU研究员的这项研究,对于MS等疾病的治疗可能会更进一步。同时,也希望能够再进一步,进入到临床试验阶段,让更多的罕见病患者从中受益,得到更加有效的治疗。
资讯来源:
1.Washington University School of Medicine. "Immunotherapy eliminates disease-causing cells in mice with MS-like disease: Successful cancer treatment approach extended to autoimmune disease." ScienceDaily. ScienceDaily, 5 December 2022.From www.sciencedaily.com/releases/2022/12/221205203255.htm