2022年,美国FDA共批准了37款新药。1月6日,渤健/卫材阿尔茨海默症(AD)新药lecanemab获FDA加速批准上市,成为2023年FDA批准的首款新药。根据FDA的审批计划,本文列举了2023上半年有望获得批准的其它10款新药,供大家参考。
1. Daprodustat(达普司他)
公司:GSK
作用机制:缺氧诱导因子脯氨酰羟化酶抑制剂
适应症:慢性肾病贫血
预计批准时间:2月1日
Daprodustat(达普司他)是一种新型口服缺氧诱导因子脯氨酰羟化酶抑制剂(HIF-PHI),用于治疗非透析依赖(NDD)和透析依赖(DD)成人慢性肾病贫血。低氧能够诱导缺氧诱导因子刺激促红细胞生成素产生,从而促进红细胞的合成。而HIF-PHI抑制脯氨酰羟化酶的结构域可以稳定缺氧诱导因子,通过增加内源性促红细胞生成素生成、改善铁的吸收、下调铁调素水平来促进红细胞的合成,进而治疗贫血。
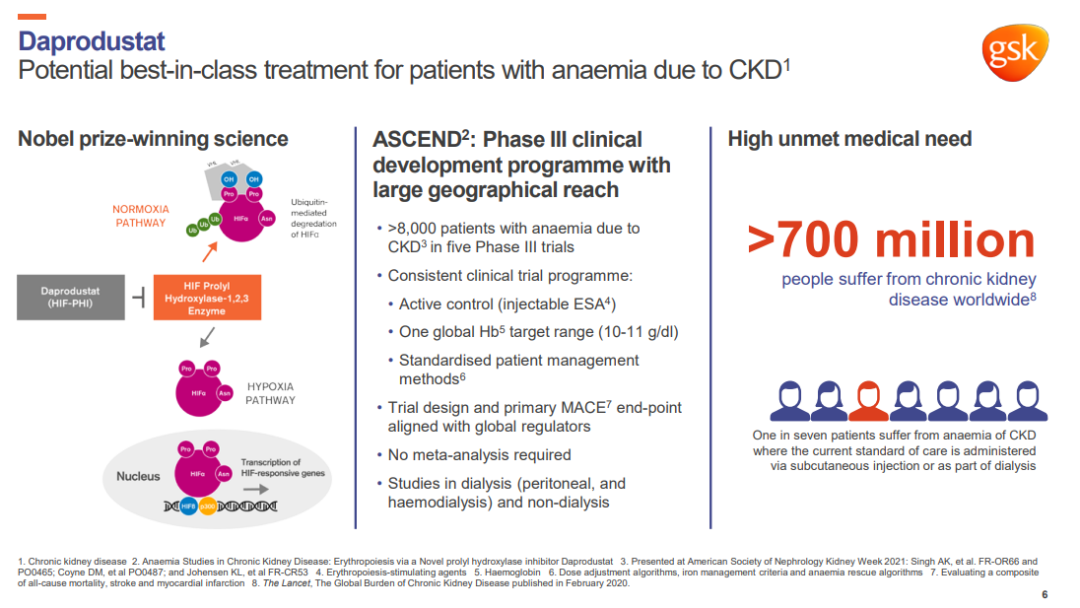
来源:GSK官网
2020年6月,达普司他在日本获批上市,用于治疗慢性肾病贫血。2022年4月19日,达普司他的上市申请获FDA受理,用于治疗慢性肾病贫血患者,PDUFA日期定为2023年2月1日。
2. Elacestrant(艾拉司群)
公司:Menarini/Radius Health
作用机制:选择性雌激素受体降解剂
适应症:ER+/HER2-晚期或转移性乳腺癌
预计批准时间:2月17日
Elacestrant(艾拉司群)是Radius公司研发的一款口服选择性雌激素受体降解剂(SERD)。2021年10月20日,Menarini/Radius联合宣布艾拉司群针对ER+/HER2-晚期或转移性乳腺癌乳腺患者的的获得了积极阳性结果。研究结果显示,无论是总人群还是在ESR1突变人群中,接受艾拉司群治疗的患者均表现出了具有统计学差异的PFS延长以及死亡风险的下降;与此同时,艾拉司群治疗显示出了良好的安全性和耐受性。
基于III期EMERALD研究的积极数据,Menarini已向FDA递交了艾拉司群的新药上市申请。FDA已授予艾拉司群优先审评资格,PDUFA日期定为2023年2月17日。如若成功获批,艾拉司群将成为全球首个上市的口服SERD药物。
3. B-VEC
公司:Krystal Biotech
作用机制:基因疗法
适应症:营养不良性大疱性表皮松解症
预计批准时间:2月17日
B-VEC是一种基因工程改造而来的复制缺陷型HSV-1载体,包含两个COL7A1基因的拷贝片段,通过恢复营养不良性大疱性表皮松解症(DEB)患者角质形成细胞和成纤维细胞中VII型胶原蛋白(COL7)的表达来实现治疗作用。B-VEC是一种非侵入性、局部应用、可重复给药的基因疗法,采用凝胶剂型设计,由皮肤科医生或初级护理医师直接应用于患者皮肤DEB伤口处,促进伤口愈合。
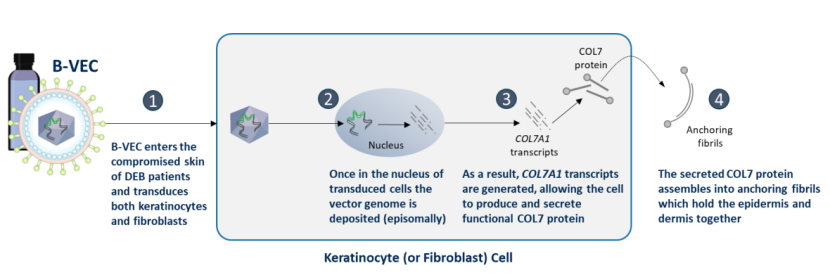
来源:Krystal官网
2022年8月18日,Krystal宣布,FDA已受理B-VEC用于DEB患者的生物制品许可申请。FDA同时授予该药物优先审查资格,PDUFA日期为2023年2月17日。此前,FDA已授予该药治疗DEB的孤儿药资格和再生医学先进疗法(RMAT)认定。如果该药物成功获批,其将成为第一种有效的DEB治疗手段。
4. Omaveloxolone
公司:Reata
作用机制:Nrf2激活剂
适应症:弗立特里希氏共济失调
预计批准时间:2月28日
弗立特里希氏共济失调(FA)是一种罕见的遗传性、衰弱性和退行性神经肌肉疾病。FA患者通常会在儿童时期出现症状,包括进行性协调功能丧失、肌肉无力和疲劳。这种疾病还会导致视力障碍、听力损失、糖尿病和心肌病。目前尚无治疗FA的疗法获批上市。
Omaveloxolone是一款在研的每日1次口服Nrf2激活剂。Nrf2是一种转录因子,通过恢复线粒体功能、减少氧化应激和抑制促炎信号来促进炎症消退。
2022年1月31日,Reata首次向FDA滚动提交omaveloxolone用于治疗FA患者的NDA。5月26日,FDA授予该药物优先审查资格认定,并将PDUFA日期定为2022年11月30日。2022年8月9日,Reata发布公告称omaveloxolone用于治疗FA患者的NDA的PDUFA日期被FDA推迟至2023年2月28日。
5. Zavegepant
公司:Biohaven(辉瑞)
作用机制:降钙素基因相关肽受体拮抗剂
适应症:偏头痛
预计批准时间:2023Q1
Zavegepant是Biohaven研发的第三代高亲和力、高选择性的小分子CGRP受体拮抗剂。这是首款小分子降钙素基因相关肽(CGRP)受体拮抗剂的鼻内给药配方,用于在成人患者中急性治疗偏头痛。2022年5月,辉瑞以约116亿美元收购Biohaven,将包括这款在研疗法在内的CGRP靶向疗法纳入其研发管线。
2022年5月24日,Biohaven宣布,FDA已受理zavegepant鼻内喷剂的NDA,PDUFA日期定为2023年第一季度。如若zavegepant成功获批,其将成为首个且唯一一个通过鼻内给药的CGRP受体拮抗剂,有望在偏头痛治疗领域开启非口服CGRP靶向药物治疗新时代。
6. Roctavian
公司:BioMarin
作用机制:基因疗法
适应症:A型血友病
预计批准时间:3月31日
Roctavian是一款使用AAV5病毒载体递送表达凝血因子VIII(FVIII)转基因的基因疗法。该疗法的优势在于可能只需要一次治疗即可获得表达FVIII的基因,因此患者不再需要长期接受预防性凝血因子注射。
2022年8月24日,欧盟批准Roctavian基因疗法的有条件上市,用于治疗体内不含凝血因子VIII抑制物和腺相关病毒5(AAV5)抗体的重度A型血友病成人患者,Roctavian也成为了首款获批的A型血友病基因疗法。
2022年10月,FDA接受了BioMarin重新递交的Roctavian疗法的生物制品许可申请,FDUFA日期定为2023年3月31日。如果获得批准,Roctavian将成为首款FDA批准治疗A型血友病的基因疗法。
7. Tofersen(BIIB067)
公司:Biogen/Ionis
作用机制:反义寡核苷酸疗法
适应症:肌萎缩侧索硬化
预计批准时间:4月25日
Tofersen是一种用于治疗超氧化物歧化酶1 (SOD1)突变所致的肌萎缩侧索硬化(ALS)的反义寡核苷酸药物。Tofersen通过结合编码SOD1的mRNA结合,使其被核糖核酸酶降解,从而减少SOD1蛋白的产生。
2022年7月26日,渤健(Biogen)/Ionis pharmaceuticals共同宣布,FDA已接受tofersen(BIIB067)用于治疗超氧化物歧化酶1 (SOD1)突变所致的肌萎缩侧索硬化(ALS)的上市申请,同时授予其优先审评资格。10月17日,渤健宣布,FDA已将tofersen NDA的审查期延长3个月,更新后的PDUFA日期定为2023年4月25日。若tofersen顺利获得批准,其将成为首款靶向ALS遗传因子的疗法。
8. Omidubicel
公司:Gamida Cell
作用机制:异体干细胞移植疗法
适应症:血液系统恶性肿瘤
预计批准时间:5月1日
Omidubicel是一款具有“first-in-class”潜力的异体干细胞疗法,适用于治疗血液系统恶性肿瘤患者。Omidubicel基于Gamida的NAM技术开发,通过美国公共脐带血库的脐带血细胞,经过扩增的CD34+ HSC与免疫细胞进行混合。该药物是第一款获得美国FDA突破性疗法认定的骨髓移植治疗产品,并且在美国和欧盟都获得了孤儿药资格认定。
2022年8月1日,Gamida Cell宣布Omidubicel的上市申请获得FDA受理,并获得优先审评资格,PDUFA日期为2023年5月1日。如果顺利获批,Omidubicel将成为全球首款异体干细胞移植疗法。
9. SRP-9001
公司:罗氏/Sarepta Therapeutics
作用机制:基因疗法
适应症:杜氏肌营养不良症
预计批准时间:5月29日
SRP-9001是一种款基因疗法,旨在将编码微肌营养不良蛋白的基因传递到肌肉组织,以靶向生产微肌营养不良蛋白来达到治疗杜氏肌营养不良症的目的。
2022年11月28日,Sarepta宣布FDA已受理SRP-9001用于治疗非卧床的杜氏肌营养不良症(DMD)患者的生物制品许可申请(BLA)。与此同时,FDA已授予SRP-9001优先审评资格,PDUFA日期为2023年5月29日。如若顺利批准,SRP-9001将成为全球首款获批上市的用于治疗杜氏肌营养不良症的基因疗法。
10. Ritlecitinib
公司:辉瑞
作用机制:JAK3/TEC抑制剂
适应症:斑秃
预计批准时间:Q2
Ritlecitinib是一款每日给药一次的口服特异性JAK3/TEC抑制剂,它能够抑制IL-15和CD-8细胞因子的信号传导,从而抑制免疫系统杀伤毛囊细胞以达到治疗斑秃的目的。
2021年8月,辉瑞宣布ritlecitinib在治疗斑秃患者的IIb/III期ALLEGRO临床试验中获得积极顶线结果。研究结果显示,两种剂量(30mg/50mg)的ritlecitinib均达到了改善头皮毛发再生的主要疗效终点。即治疗6个月后,ritlecitinib组头皮毛发脱落≤20%的患者比例显著性高于安慰剂组。
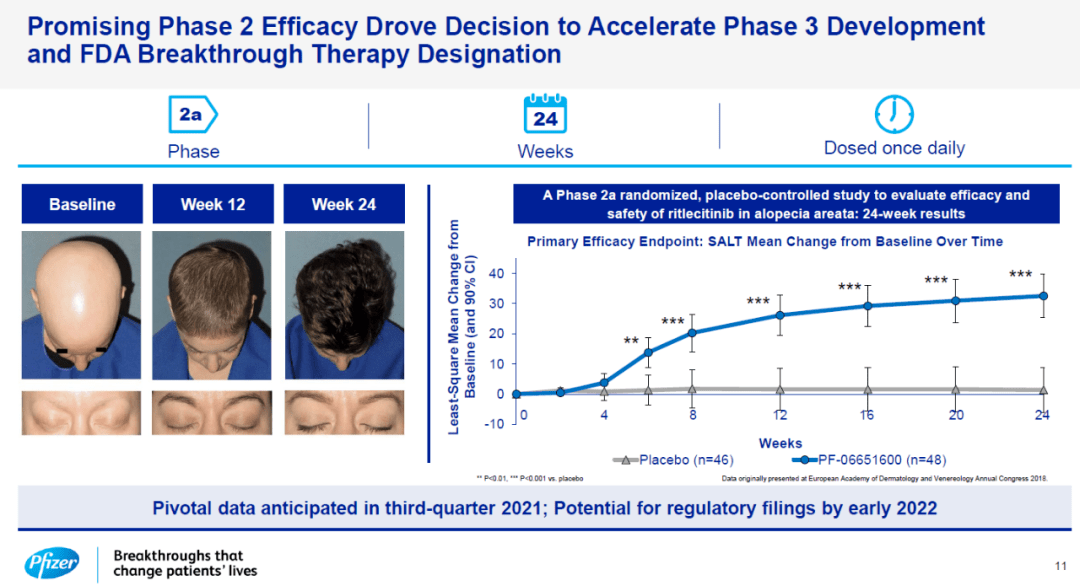
来源:辉瑞官网
2022年9月9日,辉瑞宣布FDA接受了ritlecitinib治疗12岁及以上斑秃患者新药上市申请,预计FDA将在2023年第二季度做出审批决定。