
美国Avidity公司于2023年1月18日宣布美国食品药品监督管理局 (FDA) 已授予AOC1020研究药物快速通道指定,用于面肩肱型肌营养不良症 (FSHD)治疗研究。FSHD是一种严重、罕见、遗传性肌肉无力的疾病,其特征是终生、进行性的肌肉功能丧失,会导致严重的疼痛、疲劳和残疾。AOC1020正在FSHD成人患者的 1/2 期 FORTITUDE ™临床试验中进行研究,是该公司临床开发中的第二个肌肉靶向小干扰RNA(siRNA)AOC 。Avidity公司计划在2024年上半年公布来自FORTITUDE 试验的大约一半研究参与者的AOC1020试验药物的初步评估数据。

快速通道指定使与FDA的互动更加频繁,以加快用于治疗严重或危及生命的疾病的药物的开发和审查过程,并证明有可能解决未满足的医疗需求。目前,没有FDA批准的治疗FSHD患者的方法。
快速通道认定(Fast Track Designation, FTD)作为一种加快药物研发与审评通道,是FDA为了促进用于治疗严重疾病和解决未满足医疗需求的新药研发而授予在研药物的一种资格认定。该资格认定最初被列入1997年《食品与药品管理局现代化法案》(Food and Drug Administration Modernization Act, FDAMA)中,后来修订成为2012年《食品与药品管理局安全与创新法案》(Food and Drug Administration Safety and Innovation Act,FDASIA)的一部分。
获得FTD的药物必须同时满足下列条件:
(1)用于治疗严重疾病;
(2)临床前和/或临床数据能够证明该药物具有解决未满足的医疗需求的潜力。

Avidity公司首席医疗官Steve Hughes医学博士说:“FDA对AOC1020试验药物的快速通道指定强调了寻找有效治疗方法来帮助FSHD患者的重要性,FSHD是一种破坏性和衰弱性肌营养不良症,目前没有治疗选择。AOC1020旨在直接针对致病基因DUX4,以解决FSHD的根本原因。我们期待与FDA合作,尽快将第一个直接靶向DUX4的RNA疗法带给患者。”
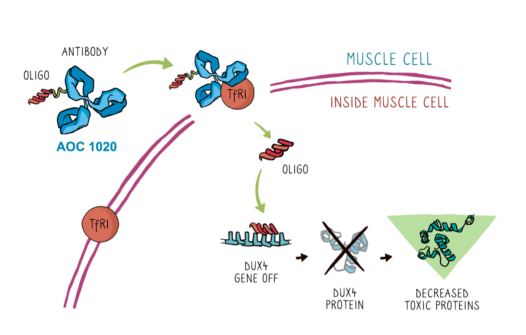
Avidity公司专有的AOC旨在将单克隆抗体 (mAb) 的特异性与寡核苷酸疗法的精确性相结合,以针对以前无法用RNA疗法治疗的疾病的根本原因。AOC 1020试验药物由一种专有的mAb组成,它与转铁蛋白受体1(TfR1) 结合,并结合了靶向DUX4 mRNA的siRNA。DUX4蛋白的异常表达导致肌肉细胞中基因表达的变化,这与FSHD患者肌肉功能的终生进行性丧失有关。

Avidity公司在临床上拥有三个针对不同的罕见疾病的药物研发项目。除了AOC1020,该公司还在1/2期 MARINA ™和 MARINA 开放标签扩展( MARINA-OLE ™)临床试验中评估AOC 1001药物,用于治疗强直性营养不良1型(DM1)和AOC1044 1/2期 EXPLORE44™ 试验用于治疗适合外显子44 跳跃 (DMD44) 的杜氏肌营养不良症 (DMD) 突变。
|AOC1020在FSHD成人中的FORTITUDE™ 1/2 期试验
FORTITUDE ™试验是一项随机、安慰剂对照、双盲、1/2期临床试验,旨在评估大约70名患有FSHD的成年参与者的AOC 1020。FORTITUDE项目将评估静脉注射AOC 1020 的安全性、耐受性、药代动力学和药效学,主要目标是AOC1020药物在FSHD患者中的安全性和耐受性。AOC 1020的活性将使用关键生物标志物进行评估,包括肌肉体积和成分的磁共振成像(MRI)测量。尽管1/2 期试验没有统计功效来评估功能益处,但它将探索AOC1020的临床指标,包括活动性和肌肉力量的测量以及患者报告的结果和生活质量测量。在 FORTITUDE研究的治疗期结束时,参与者可以选择参加开放标签扩展研究。
|关于AOC 1020药物
AOC 1020旨在治疗FSHD的根本原因,FSHD是由称为DUX4的基因异常表达引起的。DUX4蛋白的异常表达导致肌肉细胞中基因表达的变化,这与FSHD患者肌肉功能的终生进行性丧失有关。AOC 1020旨在降低FSHD患者肌肉中DUX4 mRNA和DUX4蛋白的表达。AOC 1020由专有的单克隆抗体组成,该抗体与转铁蛋白受体1 (TfR1) 结合,并与靶向DUX4 mRNA的siRNA 结合。在临床前研究中,小鼠模型中AOC 1020的单次静脉内剂量可防止肌肉无力的发展,这通过三种功能测定(跑步机跑步、体内力量和复合肌肉动作电位)得到证明。AOC 1020目前正处于1/2期开发阶段,作为FORTITUDE ™成人FSHD试验的一部分。
|FDA快速通道指定对FSHD患者意味着什么?
FDA快速通道指定并不意味着该药物已被批准供患者使用。AOC1020距离药物正式批准上市使用还有一段路要走,但FDA已经批准了一条通过新药申请和临床试验流程的更快途径,这对药物临床试验流程有很大帮助。
药物获得FTD后,新药研发公司将在在后续的药物研发与审评过程中,获得更多与FDA沟通交流的机会。在药物研发早期阶段与FDA讨论在研药物的研发计划和数据,能够及时发现和解决研发中出现的问题,有助于加快药物后续研发和批准上市。此外,新药研发公司可以在提交上市申请(NDA/BLA)时向FDA滚动递交(rolling submission)新药研究资料。这些优惠政策都为加快新药的后续研发提供了有利保障。