1月31日,Reneo Pharmaceuticals宣布美国FDA已授予mavodelpar(REN001)快速通道资格,用于长链3-羟基酰基辅酶a脱氢酶(LCHAD)缺乏症。LCHAD是长链脂肪酸氧化障碍(LC-FAOD)患者的主要基因型之一。此前mavodelpar已获FDA授予的用于治疗原发性线粒体肌病(PMM)快速通道资格。

LC-FAOD和PMM是由线粒体DNA(mtDNA)或核DNA突变(nDNA)或缺失引起的一组罕见的遗传代谢疾病。基因改变阻碍了线粒体将营养物质转变为ATP的能力,导致机体供能不足。进而引发嗜睡、肝功能障碍、低血糖、肌无力、运动不耐受、肌肉疼痛或横纹肌溶解,心脏、肾脏相关疾病,甚至可导致永久性残疾或死亡。
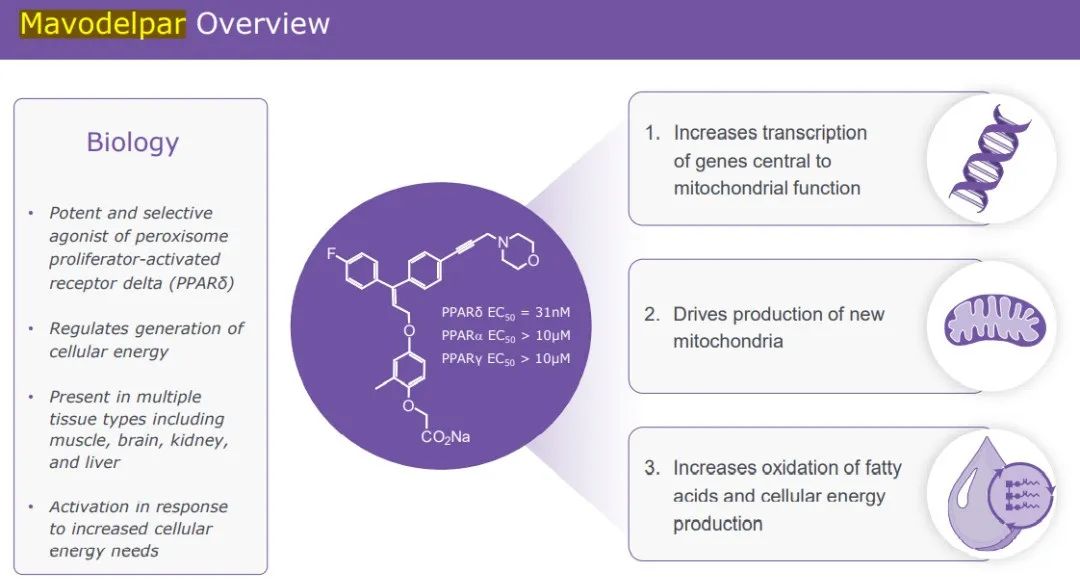
Mavodelpar是一种过氧化物酶体增殖物激活受体delta(PPARδ)的强效选择性激动剂。Mavodelpar已被证明可以增加与线粒体功能相关基因的转录,并可能增加新线粒体的产生,进而增加脂肪酸氧化,给机体供能。
该公司最近完成了一项代号为FORWARD的疾病自然史研究(natural history study)和一项开放标签研究,评估了mavodelpar在包括LCHAD基因型在内的多种基因型LC-FAOD患者中的疗效和安全性。
Reneo也正在开展一项mavodelpar治疗伴有线粒体DNA(mtDNA)缺陷原发性线粒体肌病(PMM)患者的关键临床试验(STRIDE研究),相关数据将于今年第四季度公布。
Reneo Pharmaceuticals总裁兼首席执行官Gregory J. Flesher说:“获得第二项适应症的快速通道资格认定继续巩固了mavodelpar作为罕见线粒体疾病患者的潜在治疗选择。”“我们感谢与FDA的持续合作,并期待与他们在推进LC-FAOD项目方面的合作。”