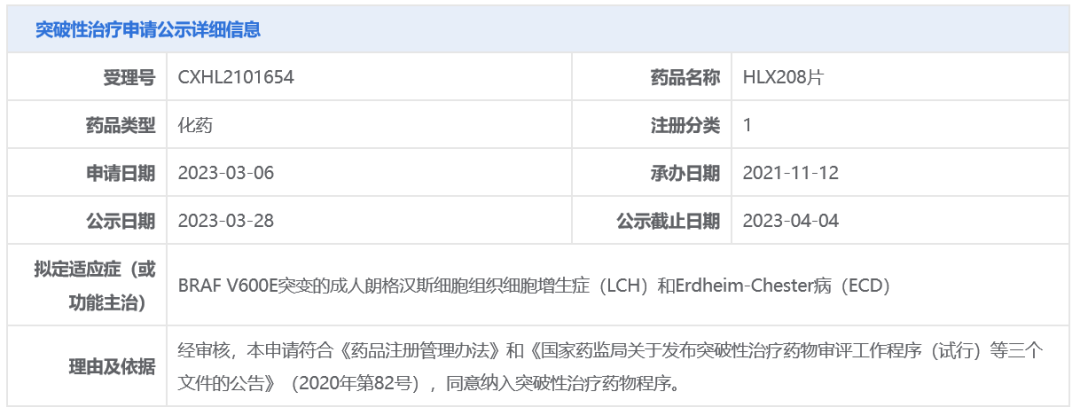
今日(3月28日),中国国家药监局药品审评中心(CDE)官网最新公示,复宏汉霖申请的HLX208片拟纳入突破性治疗品种,拟定适应症为:BRAF V600E突变的成人朗格汉斯细胞组织细胞增生症(LCH)和Erdheim-Chester病(ECD)。公开资料显示,HLX208(RX208)是润新生物自主研发的一款针对BRAF V600E突变的选择性小分子抑制剂,复宏汉霖通过与润新生物达成一项超11亿元的许可合作,获得了其中国独家权利。
BRAF蛋白是RAF家族成员之一,位于EGFR下游,为RAS-RAF-MEK-ERK信号通路中上游调节因子,在MAPK/ERK信号通路中起着重要的作用。BRAF基因突变可传导并激活下游MEK和ERK蛋白,从而引起肿瘤细胞生长、增殖和侵袭。在BRAF基因突变中,BRAF V600E突变是最常见的类型,多发于结直肠癌、黑色素瘤、甲状腺癌、肺癌和脑胶质瘤等多个癌种中,这类患者往往预后较差,需要新药的治疗选择。
公开资料显示,HLX208是润新生物自主研发的一款针对BRAF V600E突变的选择性小分子抑制剂,对BRAF V600E突变有很好的活性和选择性,临床上拟用于治疗BRAF V600E突变阳性、不适合手术的局部晚期或转移性恶性实体肿瘤。临床前研究结果表明,该候选药具有单一稳定晶型、良好的口服生物利用度及明显的肿瘤抑制活性。在早期临床研究中,HLX208也展现出了良好的安全性、耐受性和有效性。
2021年5月,复宏汉霖发布公告称,就RX208与润新生物订立许可协议。复宏汉霖获得该产品在中国(包括中国香港、澳门和台湾地区)进行研究、开发、生产和商业化等的独家权利。润新生物将获得9750万元的首付款,最高可达约10.775亿元的相关临床开发、注册和销售里程碑付款,以及产品上市后的销售提成。

此次HLX208拟纳入突破性治疗品种,拟定适应症包括朗格汉斯细胞组织细胞增生症(LCH)和Erdheim-Chester病(ECD)。根据中国药物临床试验登记与信息公示平台,此前该产品已在中国启动一项单臂、开放、多中心的2期临床研究,以评估HLX208片在BRAF V600E突变成人LCH和ECD患者中的有效性、安全性和药代动力学特征。
LCH是一种朗格汉斯细胞的肿瘤性增生,朗格汉斯细胞是组织树突状细胞。LCH可表现为单器官或多器官疾病,最常见的症状是溶骨性病变。其他受累的器官可能包括皮肤、呼吸系统、中枢神经系统、胃肠道和造血系统,以及发展到尿崩症(该患者即如此)。治疗和预后取决于受累病灶数量和部位,其中肝脏、脾脏和骨髓受累的预后较差。
ECD是一种起源于骨髓、增长缓慢的血癌。ECD会使组织细胞(一种白细胞)的产生增多,多余的组织细胞可导致肿瘤侵入身体的多个器官和组织,包括心脏、肺、大脑等。据估计,约有54%的ECD患者具有BRAF V600突变。ECD患者的预期寿命非常有限。这一群体急需新的疗法来缓解疾病。
除了LCH和ECD,HLX208还正在开展多个适应症的临床试验,包括BRAF V600E突变的晚期非小细胞肺癌、转移性结直肠癌、黑色素瘤、原发性颅内肿瘤等。复宏汉霖曾在新闻稿中指出,HLX208有望与其研发管线上的其它在研EGFR、PD-1靶点单抗产品产生协同效应,形成差异化创新产品组合,为BRAF V600E突变型患者带来精准的综合治疗选择。