在几乎所有的肌萎缩性脊髓侧索硬化症(ALS)患者以及多达一半的阿尔茨海默病(AD)和额颞叶痴呆症(frontotemporal dementia)病例中,一种叫做TDP-43的蛋白从细胞核的正常位置丢失。反过来,这又引发了stathmin-2的丢失,而stathmin-2对神经元的再生以及维持它们与肌肉纤维的连接至关重要,因而对收缩和运动至关重要。
在一项新的研究中,来自美国加州大学圣地亚哥分校、哈佛医学院和布罗德研究所等研究机构的研究人员证实stathmin-2的丢失可以用人工设计的DNA药物(designer DNA drug,下称设计DNA药物)进行拯救,从而恢复编码蛋白的RNA的正常加工。相关研究结果发表在2023年3月17日的Science期刊上,论文标题为“Mechanism of STMN2 cryptic splice-polyadenylation and its correction for TDP-43 proteinopathies”。
论文共同通讯作者、加州大学圣地亚哥分校医学院的Don Cleveland博士说,“通过我们设计的小鼠模型,使它们的编码stathmin-2的RNA加工不当,就像在这些人类疾病中一样,我们发现将这些设计的DNA药物之一注入环绕大脑和脊髓的液体中,可以恢复整个神经系统的正常stathmin-2水平。”
Cleveland被广泛认为是提出了设计DNA药物的概念,这些药物的作用是开启或关闭与人类神经系统老化的许多退行性疾病(包括ALS、AD、亨廷顿病和癌症)相关的基因。
目前有几种设计DNA药物正在进行临床试验,用于治疗多种疾病。其中的一种药物已被批准用于治疗一种名为脊髓性肌肉萎缩症(spinal muscular atrophy)的儿童神经退行性疾病。
这项新的研究建立在Cleveland和其他人正在进行的关于TDP-43的作用和丢失的研究之上,TDP-43是一种与ALS、AD和其他神经退行性疾病相关的蛋白。在ALS中,TDP-43的丢失影响了支配和触发骨骼肌收缩的运动神经元,导致它们退化,最终导致瘫痪。
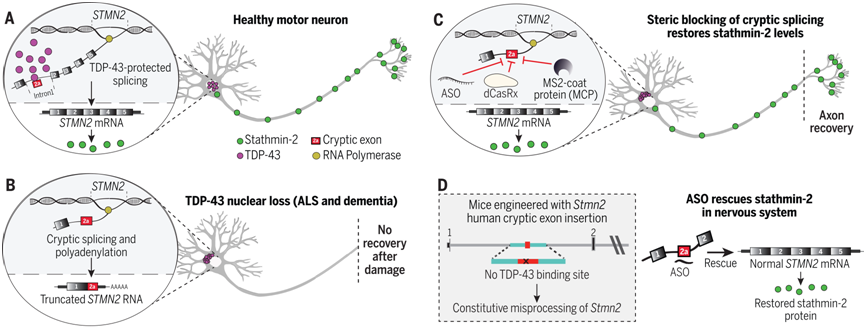
隐性剪接的空间阻断可挽救中枢神经系统中的stathmin-2水平。图片来自Science, 2023, doi:10.1126/science.abq5622。
Cleveland说,“在几乎所有ALS的病例中,都有TDP-43聚集,这种蛋白在编码许多蛋白的RNA中间物的成熟过程中发挥作用。TDP-43活性的减少导致了编码stathmin-2的RNA的错误组装,stathmin-2是一种维持运动神经元与肌肉连接所需的蛋白。没有stathmin-2,运动神经元就会与肌肉断开连接,从而导致ALS特征性的瘫痪。我们如今发现的是,我们可以用一种设计DNA药物模拟TDP-43功能,从而恢复哺乳动物神经系统中正确的stathmin-2 RNA和蛋白水平。”
具体来说,这些作者编辑了小鼠的基因,使之包含人类STMN2基因序列,然后将与特定RNA分子结合而阻止它们制造蛋白或者改变最终RNA的组装方式的反义寡核苷酸(antisense oligonucleotide)注入脑脊液。这种注射校正了STMN2 RNA前体分子的错误加工,并恢复了stathmin-2蛋白的表达,因而完全不依赖于TDP-43功能。
Cleveland说,“我们的发现为临床试验奠定了基础,通过使用我们的设计DNA药物维持患者的stathmin-2蛋白水平,从而延迟ALS的瘫痪。”
参考资料:
Michael W. Baughn et al. Mechanism of STMN2 cryptic splice-polyadenylation and its correction for TDP-43 proteinopathies. Science, 2023, doi:10.1126/science.abq5622.