通过破坏抑制性的调节结构域来重新激活沉默的γ-珠蛋白(γ-globin)的表达或许就能提供一种治疗β-血红蛋白病(β-hemoglobinopathies)的新型策略。近日,一篇发表在国际杂志Cell Stem Cell上题为“Base editing of the HBG promoter induces potent fetal hemoglobin expression with no detectable off-target mutations in human HSCs”的研究报告中,来自中国上海科技大学等机构的科学家们通过研究发现了一种新方法,其或能利用基因编辑手段来重新激活成体血液细胞中休眠的胎儿氧转运蛋白,从而有望逆转一系列人类血液疾病。
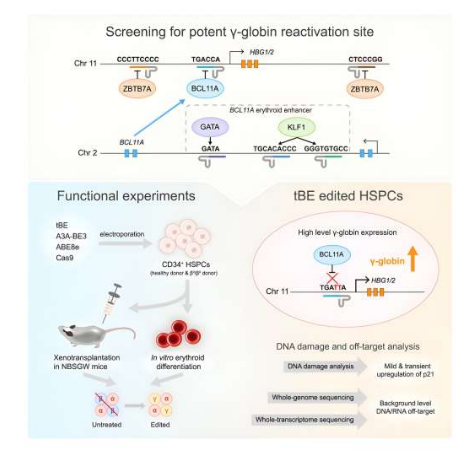
这项研究中,研究人员比较了基因编辑技术,同时还制定了可能具有重要临床应用的方法。在机体发育过程中,胎儿γ-珠蛋白在正常情况下会被成体β血红蛋白所移除,在一种奇怪的进化过程中,仅有人类和少数几种猴子机体会表现为从γ基因表达转化为β基因表达。产生胎儿血红蛋白的基因在诸如BCL11A和ZBTB7A等抑制剂的遗传开关后会变得沉默和休眠,其结合的基序也会被识别为重新激活的靶点。
包括β-地中海贫血和镰状细胞病等在内的β-血红蛋白病是由HBB基因的突变所引起的,这就会导致β-珠蛋白产生受损并引起贫血、组织氧气运输受损以及可能性的多器官组织损伤等。研究人员通过实验发现,重新激活γ-珠蛋白的表达或能发展为一种针对上述疾病的通用性治疗性策略。6种调节基序(BCL11A 增强子和HBG1/2启动子区域)能利用最近所开发的胞嘧啶碱基编辑器—变形碱基编辑器(tBE,transformer base editor)所靶向作用,文章中,研究人员将tBE与其它碱基编辑器和Cas9核酸酶在效率和脱靶效应上进行了比较。
重新激活沉默的胎儿血红蛋白基因或能帮助抵御人类镰状细胞相关疾病。
图片来源:Cell Stem Cell (2023). DOI:10.1016/j.stem.2023.10.007
文章中,tBE在靶向基序上能表现出与其它编辑器相当或更高的编辑效率,综合性分析结果表明,在tBE编辑的细胞中并未检测到脱靶突变,这就表明tBE或能作为一种安全且更为有效的潜在疗法来治疗β-血红蛋白病。对患者机体衍生的细胞进行实验,结果强调了干扰HBG1/2启动子内的BCL11A结合位点或许会导致最高水平的γ-珠蛋白表达,而对小鼠进行异种移植或能展现出对其机体造血干细胞和后代细胞的持续性编辑,且能保持移植的潜能和分化能力;由于tBE介导的编辑所导致的γ-珠蛋白表达的增加,这就意味着未来研究人员有望开发出治疗β-血红蛋白病的新型策略。
尽管编辑方法和并非直接的临床结果是研究的重点,但γ-珠蛋白表达水平的大幅提高强烈表明了其所产生的潜在临床效益,包括β-血红蛋白病患者的症状减缓和改善疾病的管理等;综上,本文研究结果表明,在造血干细胞再生过程中,tBE或能持续性地进行治疗性的编辑,这就表明,在HBG1/2启动子中tBE所介导的编辑或许能作为一种治疗β-血红蛋白病的安全且有效的疗法策略。
原始出处:
Wenyan Han,Hou-Yuan Qiu,Shangwu Sun, et al. Base editing of the HBG promoter induces potent fetal hemoglobin expression with no detectable off-target mutations in human HSCs, Cell Stem Cell (2023). DOI:10.1016/j.stem.2023.10.007