
伴随罕见病从“鲜为人知”到“广为人知”,国家政策对罕见病患者的关注和重视也在不断加强。秉持着“一个不能少”的原则,罕见病药物的市场准入和医保准入步伐加快,诊疗体系也在临床专家和医院领导的共同努力下得到进一步完善,罕见病群体亦在患者组织和核心成员的带领下共同发声、协力对抗疾病。在这个岁末年初之际,罕见病信息网特别策划了“2023年终盘点”,立足罕见病患者的多种需求,全面统计罕见病领域医疗、医保和医药政策及消息,以期共同见证不平凡的2023! 以下是年终盘点第三篇—“药物篇(美国)”—据统计,2023年美国食品药品监督管理局(FDA)批准了55种创新药物,远超于2022年。值得注意的是这55款获批新药中单孤儿药就高达28个,占获批药物总数的51%。 注:CDER(FDA药物评价和研究中心)
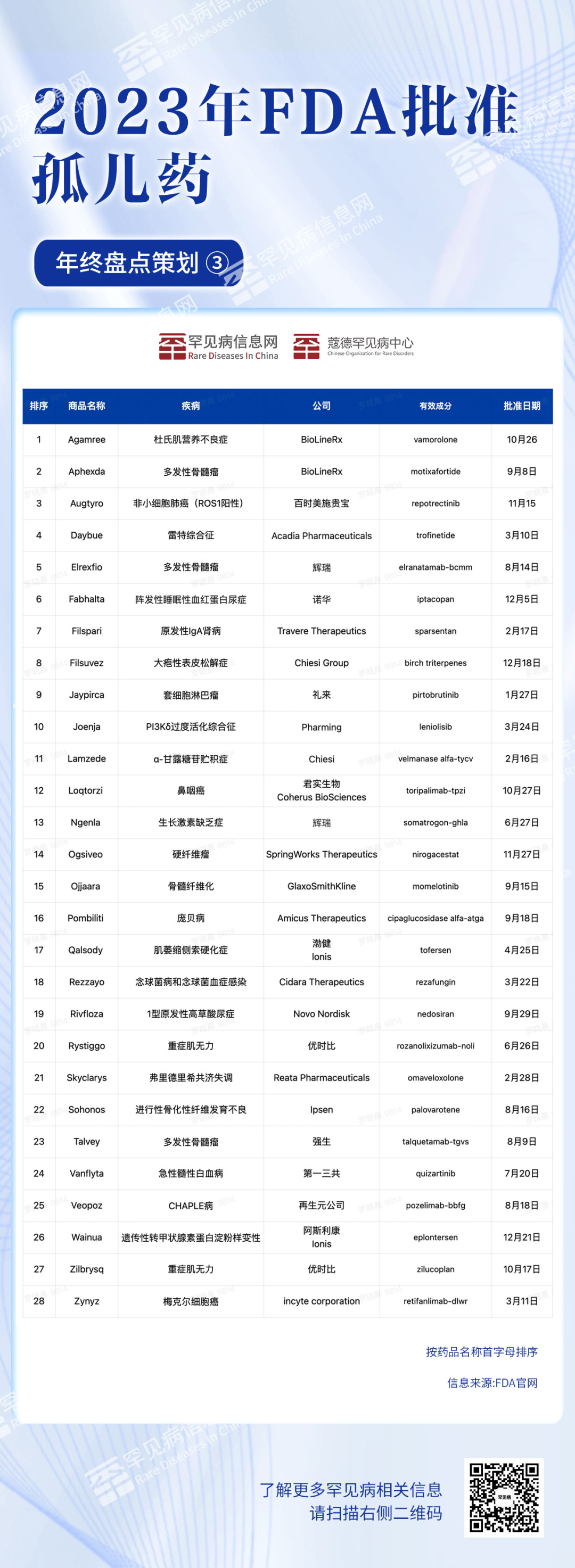
数据来源声明: 本文内所有信息均基于FDA官网整理所得。由于数据的复杂性,我们仅将此作为参考,并不构成完整的统计结果。为确保信息的准确性,罕见病信息网将持续关注相关数据的更新,如有任何遗漏或错误,欢迎后台留言联系。