2月4日,国家药监局网站发布《2023年度药品审评报告》。2023 年,药审中心采取多种措施提高审评效率,加快药品审评速度,以临床价值为导向,为患者提供更多的用药选择。报告显示,全年批准罕见病用药45个品种(未包括化药4类罕见病用药),其中15个品种(33.3%)通过优先审评审批程序得以加快上市(详见附件2), 1个附条件批准上市。

药品上市许可申请时,对于以下具有明显临床价值的药品,可以申请适用优先审评审批程序:获得适用优先审评审批程序的上市注册申请的审评时限由常规程序的200日缩短为130日,其中临床急需的境外已上市境内未上市的罕见病药品审评时限为70日。
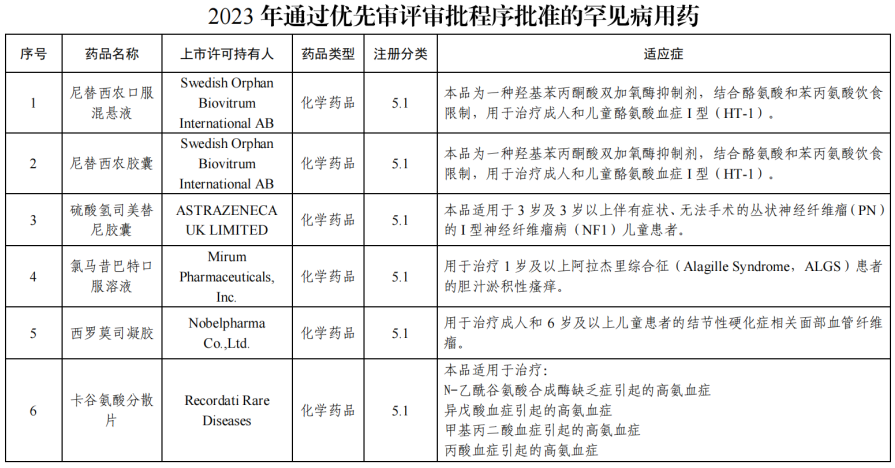
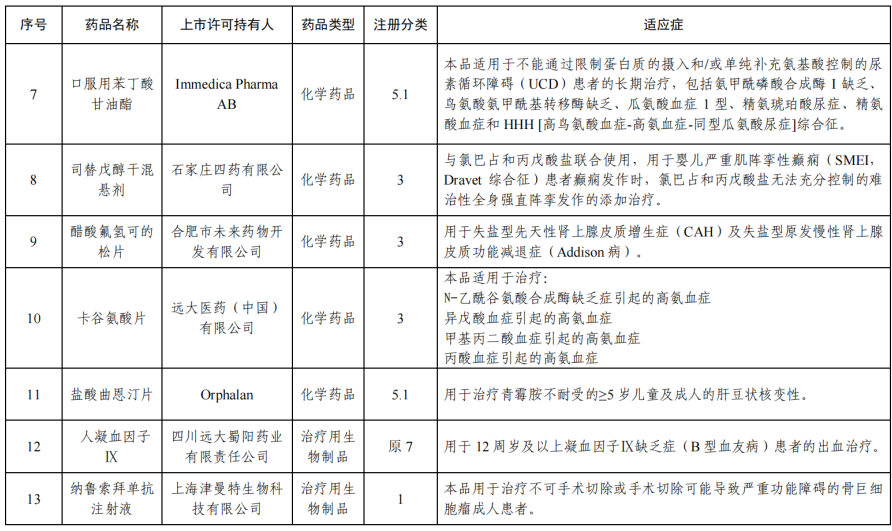
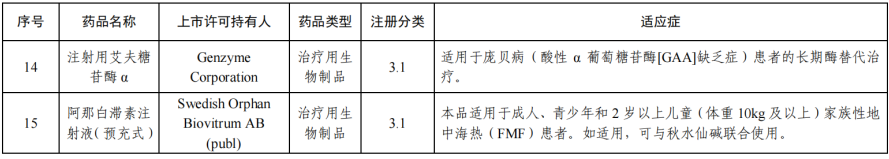
在药品研发知道原则方面,药审中心持续完善审评标准体系建设,制定发布了首个《罕见疾病药物开发中疾病自然史》。 以鼓励创新为导向,探索启动“以患者为核心的罕见疾病药物研发”试点工作,以罕见 疾病为抓手,落实“以患者为核心的药物研发”理念,在药物研发的全 程,引入罕见疾病患者的观点,倾听患者声音,切实调动罕见疾病患 者在药物研发过程中的参与意识,发挥患者观点对药物研发的指导作 用,在研发全程申请按程序要求开展相应的沟通交流,按照加快上市 注册程序要求缩短审评审批周期,促进相应罕见病药物快速上市。