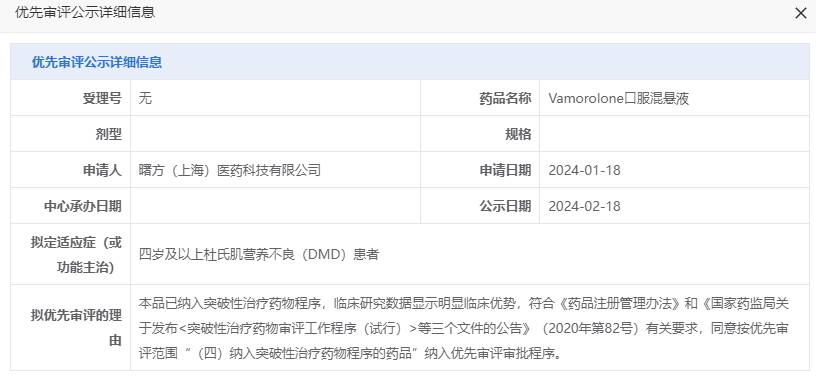
近日,中国国家药监局药品审评中心(CDE)官网公示,曙方医药联合Santhera制药申报的新药vamorolone口服混悬液拟纳入优先审评,拟定适应症为四岁及以上杜氏肌营养不良(DMD)患者。
杜氏肌营养不良(Duchenne muscular dystrophy,DMD)是一种罕见的神经肌肉疾病,多在3至5岁起病,9至12岁丧失独立行走能力,多数患者因呼吸或心力衰竭在30岁前死亡。DMD在中国大陆发病率约为1/4560男婴,估算患者数量约10万人。
公开资料显示,Vamorolone最初由ReveraGen BioPharma开发。2018年,Santhera公司获得了该药的全球研发许可(除日本和韩国以外)。2022年1月,曙方医药以1.24亿美元从Santhera引进vamorolone在中国大中华区用于DMD及其他罕见病适应症的独家开发和商业化权益。
Vamorolone是一款原创新药,其作用机制与糖皮质激素结合的受体相同但改变了其下游活性,它并非11-β-羟基类固醇脱氢酶的底物,从而不会造成局部组织扩增和局部组织中皮质类固醇相关毒性。这种机制显示出vamorolone具有将疗效与激素安全性问题“分离”的潜力,因此vamorolone可能会替代目前的糖皮质激素而成为DMD儿童和青少年患者的标准治疗方案。
在关键临床试验VISION-DMD中,与安慰剂相比,vamorolone组在治疗24周后达到主要终点、由卧位至站立所需时间(TTSTAND)与安慰剂组相比差异有统计学意义(p=0.002)。同时,vamorolone表现出良好的安全性和耐受性。与安慰剂组相比,最常见的不良事件是库欣样特征、呕吐和维生素D缺乏,不良事件的严重程度一般为轻至中度。
当前已知数据表明,与皮质类固醇不同,使用vamorolone后骨形成和骨吸收血清标志物均正常,证实其不会造成生长抑制,也不会对骨代谢产生负面影响
去年10月,FDA批准了Vamorolone口服混悬液40 mg/mL的上市申请,用于治疗2岁及以上杜氏肌营养不良(DMD)患者。截止目前,Vamorolone已在美国、欧盟、英国等地获批,将于今年一季度启动商业上市。
国内目前尚无正式获批的DMD治疗药物上市,该疾病领域存在巨大的未满足医疗需求。期待这款新药能尽快在中国上市,造福国内DMD患者。