
钟 武,军事医学科学院毒物药物研究所研究员、副所长、博士生导师,国家应急防控药物工程技术研究中心副主任,军队特需药品原料药中试基地技术总师。2012年获得总后科技新星,2015年入选国家科技部创新人才推进计划“中青年科技创新领军人才”。作为负责人先后承担完成国家科技支撑计划、重大新药创制重大专项、国家自然科学基金重大项目等23项。获得国家技术发明二等奖1项,国家科技进步一等奖1项,军队科技进步一等奖2项。发表SCI论文32篇,获中国和欧美等国授权专利85项,获军队特需新药证书4项和国家新药证书10项,其中1.1类新药证书2项。
罕见病(rare disease),又称孤儿病,是指发病率极低、患病总人数很少的疾病[1-2]。2009年起每年2月的最后一天被定为国际罕见病日。孤儿药,则是指用于预防、治疗、诊断罕见病的药品。孤儿药由于受众很小,潜在市场极小,各大制药企业对其研发一直缺乏兴趣。从20世纪80年代以来,孤儿药可及性问题日益受到关注,很多国家和地区制定专门的法律法规以促进其开发。目前,孤儿药研发已逐渐成为各大制药公司的重点。
中国尚未定义罕见病,也未出台相应法规。孤儿药的市场狭窄性极大限制了国内孤儿药开发。目前中国孤儿药几乎完全依赖进口,其研发、引进、生产及销售等环节缺乏政策支持,这已成为制约中国孤儿药产业发展的瓶颈。本文拟对国内外罕见病及其治疗药物的发展现状作一综述,并对中国的孤儿药研发提出相应的建议。
1.全球罕见病概况
世界卫生组织(WHO)将罕见病定义为:患病人数占人口总数0.65‰~1‰的单种疾病或病变。各国现有的罕见病界定标准在一定程度上有所不同(表1),大多数是以患病率或患病人数作为罕见病的界定标准[3-5]。如美国将“患者<20万人;或者虽然患病人数>20万人,但治疗药物预计难以收回其成本”作为认定标准。
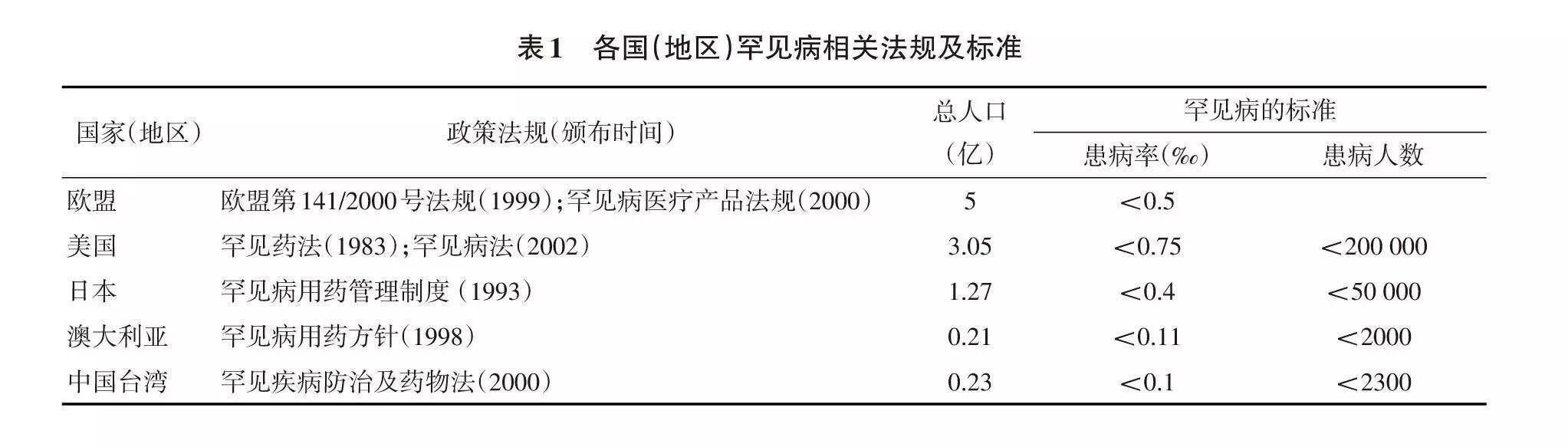
目前全球已知的疾病多达1.4万种,其中按WHO标准罕见病占6000~8000种。全球大约3.5亿人受其影响。美国约有3000万罕见病受累人群,欧洲约有2400~3600万,占欧盟25国总人口的6%~8%。大多数罕见病是由特征性的基因突变所引起。其中,90%的罕见病为严重疾病,80%以遗传为主,75%未得到规范治疗,60%为儿童发病,44%误诊率高,30%的患者寿命<5年,仅有1%的罕见病有药可治。罕见病根据不同的标准分为不同的类型,目前主要基于2007年版的国际疾病分类法(ICD-10)根据疾病的症状及发生机制进行临床分类(共为 18 大类)。
2.各国孤儿药发展概况
同罕见病情况类似,目前各国孤儿药发展水平参差不齐,界定标准也难以统一(表2)。在所有罕见病中,目前只有不到10%可以治疗,且难以根治,需终生用药。即使是在美国,绝大多数罕见病迄今仍然是无药可治。自1983年美国国会通过孤儿药法案(Orphan Drug Act,ODA)以来,美国FDA已批准近600种孤儿药用于治疗大约200种罕见病。

从20世纪80年代以来,孤儿药的开发问题开始逐渐引起社会的关注,有很多国家和地区还成立了罕见病相关机构或组织,制定了专门的法律法规以促进孤儿药的开发,其中最核心的内容就是孤儿药的独占制度[4]。随着全球各国的日益重视,罕见病治疗药物的研究和开发逐渐成为大型制药公司的重点。
2. 1 美国立法鼓励罕见病治疗药物研发
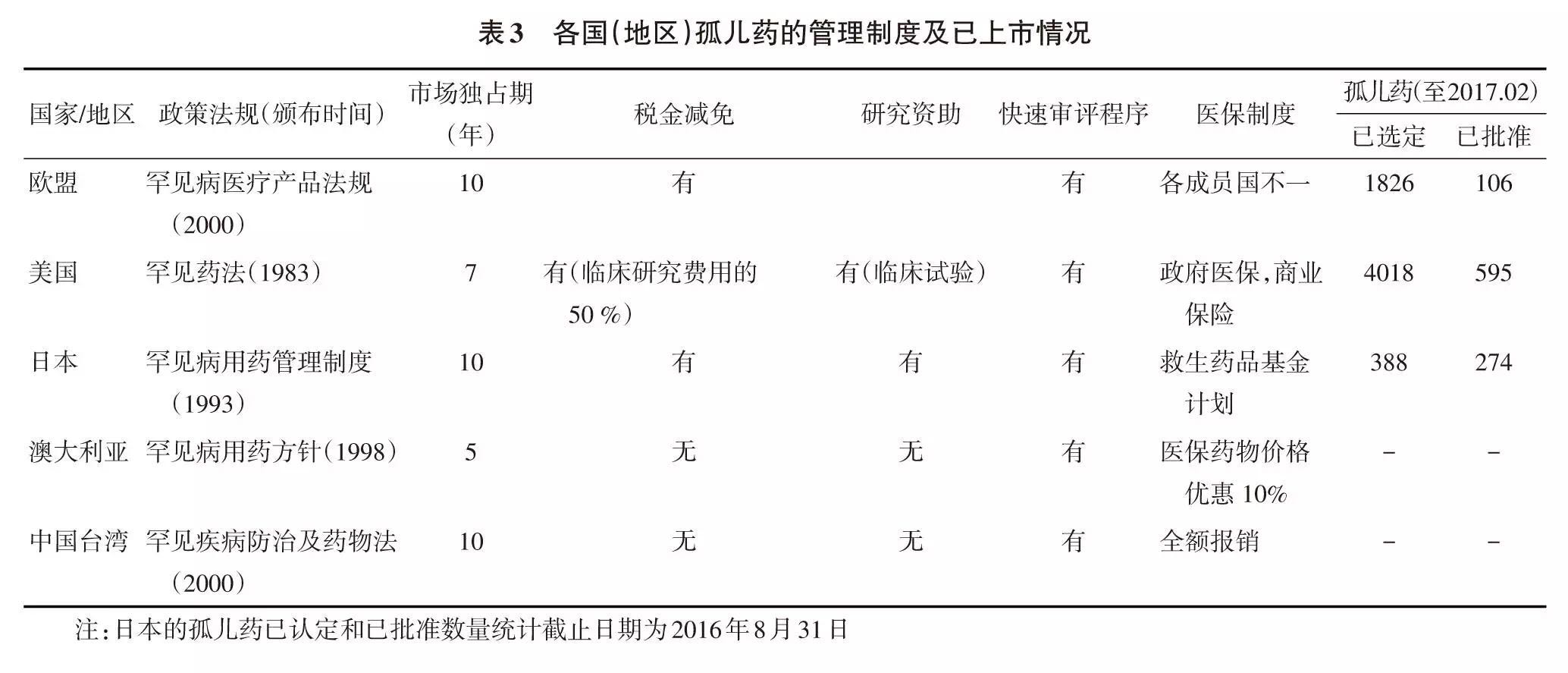
美国ODA制定的各项措施使得孤儿药研发风险大大降低,极大地促进了美国孤儿药的研究与开发。其激励政策主要包括新药申请费免除、最高达50%的研发经费退税优惠以及相关研究经费支持、享有快速审批通道资格、优先审评券、更少的临床试验人数(孤儿药在Ⅲ期临床阶段可能仅需数十个患者就被批准上市,孤儿药平均获批时间约为非孤儿药的 80%)、7年的市场独占权等[6-7]。另外,商业医疗保险也不得拒绝罕见病患者投保。虽然孤儿药一般定价很高,约为非孤儿药的6~7倍,但由于患病人数极少,商业医疗保险也愿意接收其投保,孤儿药也易进入医保目录。1983年ODA实施后,成效显著。此前世界均无孤儿药认定和上市;而至2017年2月23日,美国已有4018种产品被认定为孤儿药,其中595种获批上市。
2. 2 各国均重视罕见病药物开发
自ODA实施以来,其他一些国家和地区也相继出台相关政策(表3),大大推动了孤儿药的开发。如在欧盟和日本,2012年的孤儿药数目分别增长44%和33%。欧盟在1999年罕见病药物法规实施前仅有8种孤儿药,但到2017年2月23日已认定1826种,有106种获批上市。目前FDA和EMA每年上市的药品中,约有1/3为罕见病用药。
2. 3 孤儿药未来市场规模巨大
政策利好使越来越多的制药公司加入到孤儿药的开发中,目前全球孤儿药市场规模近1000亿美元,预计到2020年全球市场规模将达到1760亿美元,将接近处方药销售总额的19%。目前每年全球销售额超过10亿美元的品牌药中,有18种已在美国获得孤儿药资格,其中11种为重磅药。在这个重磅药时代已然结束的时候,孤儿药正成为下一个争夺的战场。
2. 4 孤儿药开发已成为制药巨头的重大策略
随着相关技术的发展以及各方政策的支持,孤儿药研发已逐渐成为各大制药公司的重点。心血管和高血压等传统疾病领域药物研发进入平台期,孤儿药研究转而得以重视。罕见病发病机制相对明确,靶点易确定,研发成功率反而较高;罕见病患者少,使得临床试验得以减免,开发进程反而加快;人道因素也使孤儿药更易进入医保。
从孤儿药做起,再扩大开发多适应证,已成为当前制药巨头药物开发的重要策略。目前孤儿药常针对一些常见肿瘤和血液病等的亚型,如目前全球最畅销的10种孤儿药就是针对此类疾病,美国批准的30%~40%孤儿药也为抗肿瘤药物。2013年FDA批准的8种孤儿药中有5种是治疗肿瘤的某亚型,且其适应证在上市后得以不断扩大。
3.中国罕见病诊治现状
3. 1 中国罕见病定义及种类
中国迄今尚无法律法规定义罕见病。2011年中华医学会给出中国罕见病定义:成人患病率<1/50万,新生儿中发病率<0.1‰的遗传病可视为罕见病[8]。目前来看,WHO、美国、欧盟、日本等罕见病界定标准相对成熟,对界定中国罕见病具有借鉴意义。
中国台湾的情况与中国大陆相似,表4列举了该地区罕见疾病名单,共收入193种罕见病[9]。中国人口基数较大,按WHO 0.65‰~0.1‰的发生率计,罕见疾病患者已超过千万,并随着新病种增加不断上升。表5略统计了中国部分罕见病的发病率以及相关治疗费用等情况。



3. 2 目前中国罕见病治疗的措施和手段
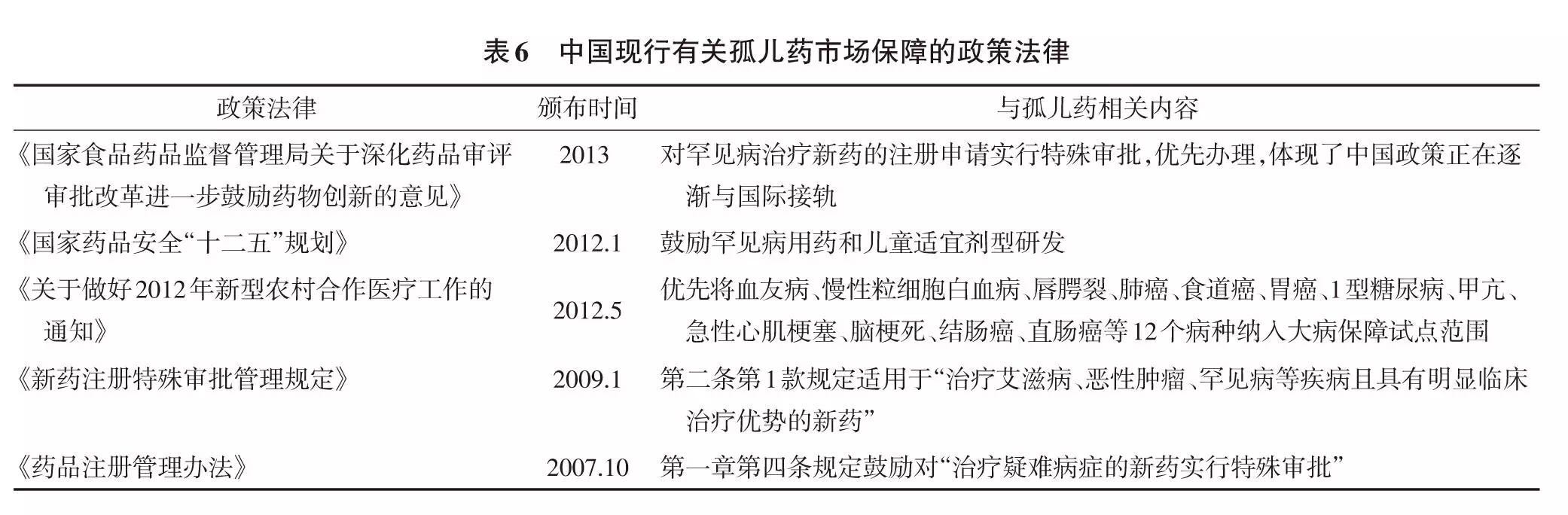
中国目前尚没有专门的孤儿药法律,有关孤儿药市场保障政策零散分布在其他政策法律中,尚未形成体系(表6)。中国尚处于创新转型期,新药研发能力相当薄弱,而孤儿药的市场狭窄性,极大限制了国内孤儿药开发, 中国孤儿药自主研制市场几近空白,主要依赖进口。目前中国已上市的孤儿药约145种,远远不能满足罕见病的治疗需求。
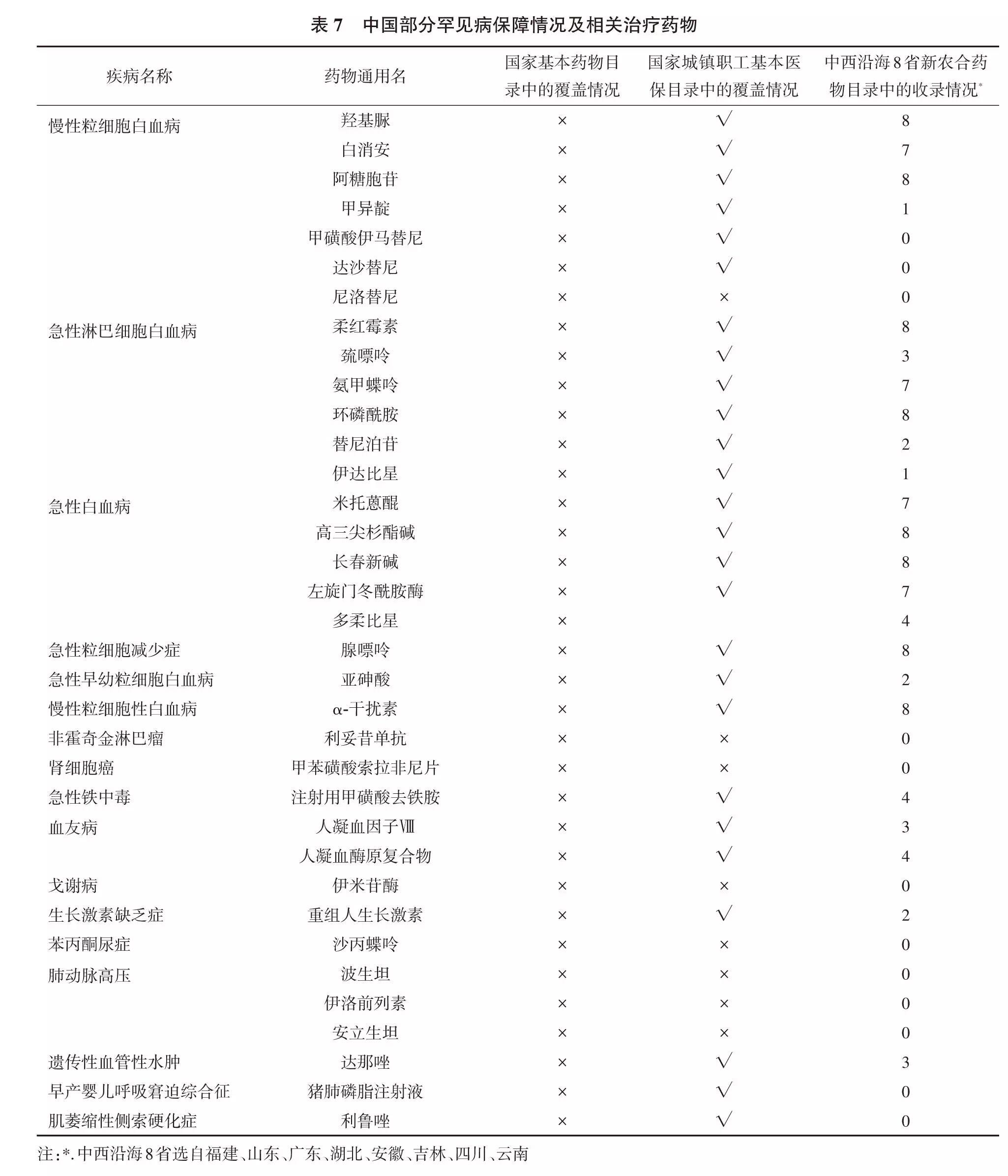
1983~2011年美国上市的360种孤儿药中,仅有近60种在中国上市,品种多为2002年之前在美国以孤儿药资格上市的抗艾滋病药物、抗结核药物、恶性疟疾、麻风病、囊虫病、隐球菌性脑膜炎、肠阿米巴病等药品。另外,由于缺乏专门针对孤儿药的遴选机制,中国基本药物目录、医保药物目录中孤儿药数量少,医保支付比例也不高。表7列举了国内部分罕见病保障情况及相关治疗药物[10]。
4.对中国罕见病治疗药物的发展建议
近年来,随着中国综合国力的增强、新药创制能力的持续提升,对中国罕见病的重视程度也在逐渐提高,已有多项 “两会” 提案呼吁建立国家罕见病医疗保障制度。但孤儿药研发在中国刚刚开始,对于孤儿药的发展,应设立优先开发目录和制定长远规划。
近期建议主要针对危害重大、可治、受益面广特别是儿童、特殊人群的罕见病,快速追踪国外已上市药物和开展老药新用研究,重点解决孤儿药的可及性和可负担性问题。远期建议开展中国的罕见病谱研究,并针对中国人特有的基因突变开展靶向治疗药物和配套药物伴侣的研究。
4. 1 具有重大危害的罕见病种类
应重点关注中国临床病人相对较多,对病患造成重大危害的、并缺乏有效治疗药物的罕见病,如苯丙酮尿症、戈谢病、黏多糖贮积症、庞贝病、重症肌无力、多发性硬化症、肢端肥大症、结节性硬化症、生长激素缺乏症、库欣病、家族性淀粉样多发性神经病、囊性纤维化等(表8),这些罕见病共涉及先天性代谢异常、脑部或神经系统病变、呼吸循环系统病变、皮肤病变、 骨及软骨病变、 血液疾病、 内分泌疾病、 其他等8大类别。

4. 2 建议发展治疗药物的种类
4. 2. 1 快速追踪研究的药物 针对目前可治疗的罕见病,快速追踪研究国内没有上市的国外药品或相应的国产药,应是孤儿药研发的主流方向。一些具有罕见病适应证的药物已经有国内企业在生产、申报,但这些药物主要是针对各类恶性肿瘤,适应证包括多发性骨髓瘤、Lennox-Gastaut综合征、急/慢性淋巴细胞白血病、急/慢性粒细胞白血病和肺动脉高压等。
建议重点选择市场调节机制失灵,需国家鼓励支持、危害重大的罕见病开展孤儿药快速追踪研究。表8列举了建议开展快速跟踪的29个品种。其中包括部分老药新用的范畴,如老药的新适应证和新剂型。
4. 2. 2 与诊断罕见病关联的药物伴侣 与罕见病关联的诊断试剂对孤儿药开发非常关键,应在品种开发时予以关注和匹配研发。表9 为FDA 批准上市的针对罕见病的药物伴侣。遗传基因缺陷所致的罕见病多有复杂的系统性症状,临床试验治疗终点往往难以确定,而生物标志物可提供有效的早期替代终点。生物标志物对于药物应答的诊断可被开发成药物的伴随诊断试剂,除用于检测药物的疗效还可预测药物在特定患者的治疗作用。

4. 3 罕见病治疗综合措施能力建设
4. 3. 1 快速诊断能力 目前罕见病特效治疗药物的研发仍面临诸多挑战:罕见病往往病理复杂,患者又少,部分疾病进展慢,临床试验时间漫长,难以及时有效地对药物的有效性和安全性进行评估,相关的临床前实验动物模型也极度缺乏。这些问题的解决,亟需借助于生物标志物的开发,而且目前大多数针对罕见病的治疗新方法多处于早期研究阶段,尤其需要依赖快速发现和诊断能力的提高。
4. 3. 2 创新药物发现及其产业化能力 目前中国孤儿药几乎完全依赖进口,药企过分关注短期的经济效益,尚不重视孤儿药的研发与生产,更愿意在其他大品种病上投入,因此亟待加强国家治疗罕见病的创新药物研发及其产业化能力建设。鉴于中国人口基数大,患者资源丰富,可优先考虑开发用于治疗病因和发病机制明确的严重疾病的新药,包括针对中国人特异突变的靶向治疗药物;罕见病患者人数少,分子基础多与特征性遗传突变相关,特异性靶向治疗前景广阔。
人口多,病例数相对大,是中国新药走向国际化的有利条件之一。同时加强国际交流与合作,与走在孤儿药研发前列的国家和地区开展合作,技术共享,共同应对罕见病[11]。孤儿药相对宽松的准入条件和缩短的获批时间可能成为中国药企走向世界的一条捷径。以上诸方面均可作为中国罕见病治疗创新药物研发和能力建设的切入点。
4. 3. 3 临床试验基地建设 如上所述,针对罕见病的孤儿药研发,同其他药物开发相比,在临床试验阶段有很大不同。开展国家临床试验基地(罕见病)建设,集中力量组织针对部分罕见病防治的联合攻关,进行相关平台(临床科研一体化信息共享平台、科研方法与规范平台、伦理学平台等临床研究平台和基础技术平台)建设,实现罕见病临床和科研的有机结合,力争在治疗手段和方法上有所突破, 形成较为成熟的综合治疗方案和新药,构建起符合罕见病特点的创新体系。
5.政策建议
罕见病市场较小,研发费用高,投入回报低,且中国缺乏罕见病及其用药的法律界定,对孤儿药研发、引进、生产及销售等环节缺乏政策支持,已成为目前制约中国孤儿药产业发展的瓶颈。WHO推荐欧盟、日本和美国实施罕见病药物立法以刺激孤儿药研发的做法,如设立孤儿药申请快速审批通道、减免申报费用、政府资助企业部分研发经费、税收抵免、给予孤儿药市场独占权和医保政策扶持等。
建议借鉴发达国家及地区罕见病管理经验,尽快制定孤儿药相关法案,明确罕见病的定义,多方联动,制订科研激励政策和产业政策,激励中国制药企业开展孤儿药的研究与开发[12]。
【参考文献】
[1] Lavandeira A. Orphan drugs: legal aspects,current situation[J]. Haemophilia,2002,8(3):194-198.
[2] Haffner ME. Developing treatments for inborn errors: incen-tives available to the clinician[J]. Mol Gen Metab,2004,81(Suppl 1):S63- S66.
[3] Sharma A, Jacob A, Tandon M, et al. Orphan drug: development trends and strategies[J]. Pharm Bioallied Sci,2010,2( 4):290-299.
[4] 张延军,王静波,郭剑非.美国孤儿药法案及其对新药研发的影响[J].中国药物经济学,2010,1: 27-34.
[5] 魏 珉,张瑞丽,赵志刚.罕见病当前国际政策及现状介绍
[J].药品评价,2010,7(22):48-51.
[6] Evaluate Pharma. Orphan Drug report, 2014 [EB/OL].(2014-11-30)[2015-08-01]. http://www.evaluategroup.com/.
[7] 杜 涛,龚兆龙,高 翼.美国孤儿药开发的政策、策略与实践[J]. 药学进展.2015,39(8): 566-570.
[8] 吴诗瑜,张 勘.中国建立罕见病研究和防治策略的机遇与未来挑战[J].上海医药,2011,32(10): 502-504.
[9] 台湾财团法人罕见疾病基金会. 罕见病分类与介绍[EB/OL].(2015-03-17)[2017-01-25]. http://www.tfrd.org.tw/tfrd/rare-b
[10] 胡娟娟,龚时薇,许 燚,等.我国罕见病及罕用药基本医疗保险覆盖现况分析[J].中华医院管理杂志,2013, 29(8):573-577.
[11] 苏 月,李萍萍,朱 敏,等.我国亟需推动罕见病用药的研发和产业化[J].中国生物工程杂志,2015,35(7) : 117-118.
[12] 贺云龙,田侃.欧美经验对我国孤儿药研发的借鉴意义刍议[J].中国药业,2014,23(24):6-8.
原文刊载:《国际药学研究杂志》2017,44(2)85-94页
本文来源 国际药学研究