
近日,欧盟委员会(The European Commission ,简称EC)已批准SPINRAZA(nusinersen)用于治疗5q型脊髓性肌萎缩症(5q spinal muscular atrophy),这也是欧洲首个批准的脊髓性肌萎缩症(SMA)治疗药物。SMA可分为多种类型,也有5q型SMA与非5q型SMA之分,而5q型SMA是SMA中最常见的类型(1-4型),约占SMA病例中的95%,是由5号染色体上的SMN1(运动神经元生存蛋白1)基因突变所引起的,因此被称为5q型SMA。
在16年10月,欧洲药物管理局(EMA)已通过了SPINRAZA 作为脊髓性肌萎缩疗法的上市许可申请,欧洲药物管理局人用药品委员会(CHMP)将SPINRAZA的申请列为“加速评估”。同时,百健也已在日本、加拿大和澳大利亚提交监管申报文件。
去年12月,美国FDA率先批准了SPINRAZA上市,使得SPINRAZA成为首个也是唯一在美国获批治疗SMA的药物。而在今年5月FDA又授予Cytokinetics的实验性药物CK-2127107治疗SMA的孤儿药地位(orphan drug designation)。
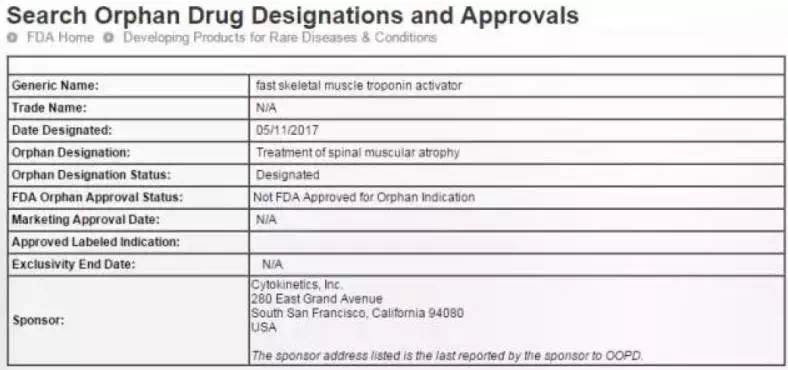
CK-2127107被FDA授予治疗SMA的孤儿药地位
“今天,是值得欧洲SMA患者及家属们庆贺的一天,基于强大的疗效和安全性的临床试验证明,我们相信SPINRAZA对罹患SMA的婴儿、儿童以及成年人具有深远的意义。” Biogen公司首席执行官Michel Vounatsos说到,“改善SMA患者(及受影响的家庭等)的生活质量是我们的使命之一,我们会坚定承诺,致力于与医疗保健专业人士、倡导团体和政府机构的合作,以确保(适用SPINRAZA的)SMA患者能够尽快获得这个重要的治疗。”
SPINRAZA是一种反义寡核苷酸(ASO),治疗由5号染色体上SMN1基因突变所引起的脊髓性肌萎缩症。SPINRAZA改变SMN2前mRNA的拼接,从而增加全长SMN蛋白的生产。ASOs是短的合成核苷酸串,为选择性结合到靶点RNA并调节基因表达。通过这种技术,SPINRAZA有潜力增加SMA患者中全长SMN蛋白的数量。
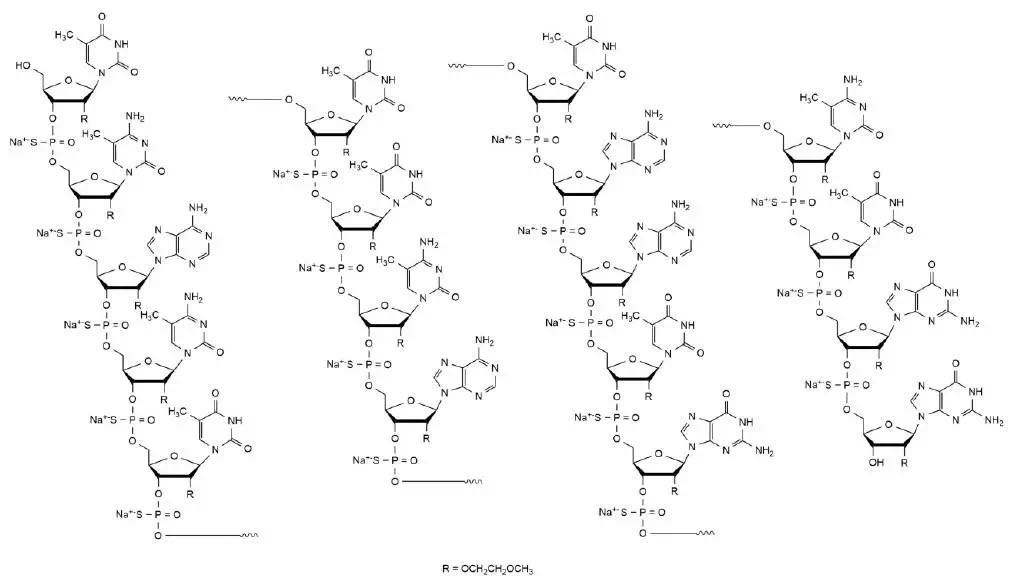
SPINRAZA 的分子式是 C234H323N61O128P17S17Na17,分子量为7501.0道尔顿
(dalton,1 dalton相当于1.661×10-24 g)
此次欧盟委员会批准的是用于治疗5q型SMA,但SMA中还有其它一些类型不是由SMN1基因的突变所致,它们就被称为非5q型SMA,意思就是说它们的致病基因并不位于5号染色体的SMN区域。和5q型SMA类似,非5q型SMA的患儿很早也就会出现肌肉无力的症状,但会有一些不同之处,其中包括是远端肌肉而非近端肌肉无力、较早出现的远端关节挛缩、隔肌麻痹伴随较早出现的呼吸衰竭及小脑变性等。
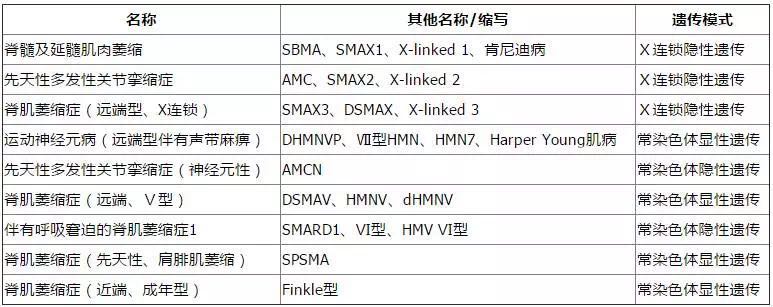
非5q型SMA
有一些非5q型SMA的缺陷基因已经被确定,相关家庭成员现在已经可以接受直接的突变分析了。但是,仍然还有一些非5q型SMA的致病基因和突变没有被确定。尽管如此,医生仍然可以通过遗传连锁研究来确认非5q型SMA的诊断及有关家庭成员是否是携带者。目前正在进行的研究最终将确定导致这些疾病的突变。
参考:
SPINRAZA® (Nusinersen) Approved in theEuropean Union as First Treatment for Spinal Muscular Atrophy
http://media.biogen.com/press-release/investor-relations/spinraza-nusinersen-approved-european-union-first-treatment-spinal-
spinraza-prescribing-information
https://www.spinraza.com/en_us/home/important-safety-information.html
SMA疾病简介. 美儿SMA关爱中心
美国FDA批准脊髓性肌萎缩新药SPINRAZA上市. 中国罕见病